
| a | | | |||||||||||||||
| b | | | | c | d | e | f | | |||||||||
| g | h | i | j | | k | l | m | ||||||||||
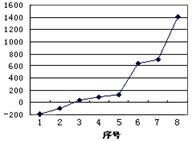
| n | | | | | | | o | | | | | | | | | | |
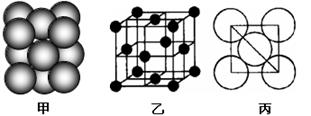
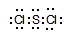 (2分) ;分子 (1分)
(2分) ;分子 (1分)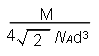 或
或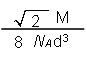 (2分)
(2分)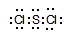 。
。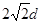 ,所以有
,所以有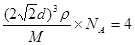 ,解得ρ=
,解得ρ=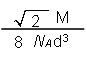 。
。

科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.沸点:HCl < HF < H2O |
| B.离子半径大小:Cl->S2->K+ |
| C.已知Ksp(AgCl)>Ksp(AgBr),则AgBr不可能转化成AgCl |
D.结合H+的能力: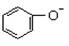 > CO32-> CH3COO- > CO32-> CH3COO- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在化合物中呈+2价 | B.氢氧化物呈两性 |
| C.单质与水反应,放出氢气 | D.碳酸盐难溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | | | |||||||
| | | | | | C | D | | | |
| A | | B | | | E | F | | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2(x+n) | B.2(x-n)+1 | C.2(x +n)+1 | D.n+2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com