
| ʵ����� | �� | �� | �� |
| �����ĩ����/g | 13.68 | 27.36 | 34.20 |
| ����������������״����/L | 2.912 | 5.824 | 6.720 |
| 6.720L |
| 22.4L/mol |
| 0.1344L |
| 22.4L/mol |
| 6.720L |
| 22.4L/mol |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na��H2O��Ӧ��Na+H2O=Na++OH-+H2�� | ||
| B��NH4HCO3��Һ������NaOH��Һ��ϣ�HCO3-+OH-=CO32-+H2O | ||
| C����С�մ�����θ����ࣺCO32-+2H+=CO2��+H2O | ||
D�������������������������Һ��Ӧ��CH2BrCOOH+NaOH
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 26g |
| 100g |
| A����H-T��S��0��S��0 |
| B����H-T��S��0��S��0 |
| C����H-T��S��0��S��0 |
| D����H-T��S��0��S��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����³�ѹ��28gCO |
| B����״����22.4LN2 |
| C������4molH��CH4 |
| D��NA ��NO���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������ | ����� | ����� | �ǵ���� | |
| A | ���� | ˮú�� | ���� | ͭ |
| B | ���� | ʯ��ˮ | ���ᱵ | NH3 |
| C | ��� | ������Һ | �Ȼ�����Һ | �������� |
| D | ������ | ������������ | ���Լ���Һ | �Ҵ� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
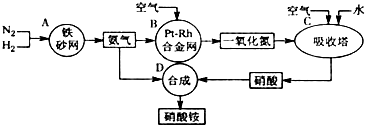
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
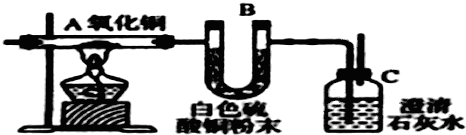
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
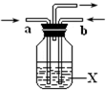 A��B��C��D��E��F��G��H����Է�������������������壬���Ǿ��ɶ�����Ԫ����ɣ������������ʣ�
A��B��C��D��E��F��G��H����Է�������������������壬���Ǿ��ɶ�����Ԫ����ɣ������������ʣ��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com