
| A. | 两种难溶电解质作比较时,Ksp小的,溶解能力一定小 | |
| B. | 欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好 | |
| C. | 所谓沉淀完全就是用沉淀剂将溶液中的某一离子除尽 | |
| D. | 若已知Ksp(CaCO3)<Ksp(CaC2O4),欲使Ca2+沉淀最完全,选择Na2CO3作沉淀剂效果比Na2C2O4好 |
分析 A.类型相同的难溶电解质,Ksp小的其溶解能力小;
B.欲使溶液中某离子沉淀完全,应使离子转化为溶度积较小的难溶电解质,且沉淀剂一般稍过量;
C.一般认为离子浓度为1×10-5mol/L时沉淀完全;
D.离子转化为沉淀时,Ksp越小效果越好.
解答 解:A.类型相同的难溶电解质,Ksp小的其溶解能力小,如AgCl、AgI等,不同类型的难溶电解质中Ksp小的溶解能力不一定小,故A错误;
B.欲使溶液中某离子沉淀完全,应使离子转化为溶度积较小的难溶电解质,且沉淀剂一般稍过量,不能越多越好,故B错误;
C.一般认为离子浓度为1×10-5mol/L时沉淀完全,离子不能除尽,故C错误;
D.离子转化为沉淀时,Ksp越小效果越好,由Ksp(CaCO3)<Ksp(CaC2O4),可知欲使Ca2+沉淀最完全,选择Na2CO3作沉淀剂效果比Na2C2O4好,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的应用、沉淀的生成及除杂为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 7.5mol | B. | 1.5mol | C. | 3mol | D. | 3.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
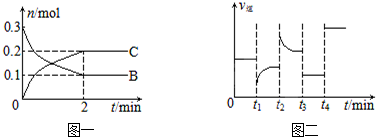
| A. | t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大 | |
| B. | t1时改变的条件是降温,平衡逆向移动 | |
| C. | t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变 | |
| D. | x=2,反应开始2 min内,v(B)=0.1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
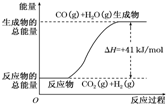 (1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
(1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol →
→
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
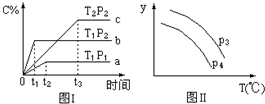
| A. | P3>P4,y轴表示B的转化率 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3<P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
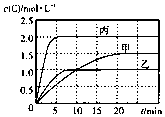 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
| A. | 若平衡时温度不变,改变容器体积平衡不移动 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | l0min内甲容器中反应的平均速率v(A)=0.025mol•(L•min)-1 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com