
| A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O =SO32-+2HClO |
| B.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+2Cl2=2Fe3++2Br2+4Cl- |
| C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2+ +2OH-= BaSO4↓+2H2O |
| D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-= NH3↑+H2O |
科目:高中化学 来源:不详 题型:单选题
| A.金属钠溶于足量水中的离子方程式:Na+2H2O=Na++H2↑+2OH- |
| B.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、Cl-可以大量共存 |
| C.等物质的量浓度、等体积的氨水与盐酸混和,溶液中离子浓度关系为c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中c(K+)=c(H2X)+c(HX-)+c(X2-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.大理石溶于盐酸中:CO32-+2H+= CO2↑+H2O |
| B.AlCl3溶液中加入过量氨水:Al3++3NH3?H2O =Al(OH)3↓+ 3NH4+ |
| C.硫酸镁溶液与氢氧化钡溶液混合:SO42- + Ba2+ =BaSO4↓ |
| D.氯化铁溶液中加入铜片:Fe3++Cu = Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O |
B.三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
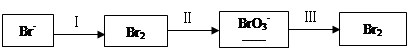
 Na2CO3=
Na2CO3= NaBrO3+
NaBrO3+ CO2+
CO2+ ______
______
| 粒子 | I2 | Br2 | IO3- |
| 物质的量/mol | 0.5 | 1.3 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.亚硫酸的电离:H2SO3 2H++ SO3 2H++ SO3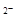 |
B.氯化铵水解的离子方程式为:NH4+ +H2O  NH3·H2O + H+ NH3·H2O + H+ |
C.NaHCO3水解的离子方程式为:HCO3-+H2O CO3 CO3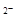 +H3O+ +H3O+ |
D.向氯化铝溶液中加入过量的氨水:A1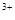 +3NH3·H2O= Al(OH)3↓+3NH4+ +3NH3·H2O= Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O |
B.以石墨作电极电解CuCl2溶液:2Cl-+2H2O  2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.铜跟浓硝酸反应:Cu+4HNO3(浓)= Cu2++2NO3-+2NO↑+2H2O |
| D.NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32-= CO2 + H2O |
| B.铁和稀硫酸反应:Fe + 2H+= H2 + Fe3+ |
| C.NH4HCO3溶液中加入过量的NaOH溶液:NH4+ + OH-= NH3+H2O |
| D.NaHCO3溶液与NaOH溶液反应:OH- + HCO3-= CO32- + H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com