
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:
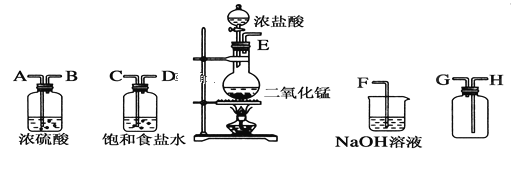
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)①气体发生装置中进行反应的化学方程式:_____________________________;该方程式中体现浓盐酸的__________________、____________________ 性质;氧化剂和还原剂的物质的量之比:________________________________________;
②NaOH溶液中发生反应的离子方程式:_______________________________________;
(4)实验室用下列方法制取氯气:①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应;②用87 g 二氧化锰与足量浓盐酸反应,若不考虑氯化氢的挥发,则反应后所得氯气的物质的量(_____)
A.①比②多 B.②比①多 C.两种方法一样多 D.无法比较
【答案】E C D A B H G F 除去氯气中的HCl杂质 吸收过量的氯气 MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 酸性 还原性 1:2 2OH-+Cl2=Cl-+ClO-+H2O B
MnCl2+2H2O+Cl2↑ 酸性 还原性 1:2 2OH-+Cl2=Cl-+ClO-+H2O B
【解析】
实验目的为制取干燥纯净的氯气,制取氯气时,浓盐酸具有挥发性,则制取的氯气中含有氯化氢、水等杂质,在收集前用饱和食盐水除去HCl杂质,用浓硫酸除去水蒸气,得到干燥的氯气,氯气的密度大于空气,则用长进短出的集气瓶收集氯气,氯气有毒则需进行尾气处理,用NaOH溶液吸收。
(1)根据分析可知,仪器的连接顺序为E、C、D、A、B、H、G、F;
(2)制取氯气的装置中有浓盐酸,具有挥发性,则饱和食盐水的作用为除去氯气中的HCl杂质;氯气有毒,不能直接排放到大气中,则NaOH溶液的作用为吸收过量的氯气;
(3)①实验室用二氧化锰与浓盐酸共热制取二氯化锰、氯气和水,方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;反应中,HCl中的Cl化合价升高,作还原剂,表现还原性;还与二氧化锰反应生成盐和水,表现酸性;二氧化锰作氧化剂,HCl作还原剂,根据方程式,化合价降低的Cl原子为2,则氧化剂和还原剂的物质的量之比为1:2;
MnCl2+2H2O+Cl2↑;反应中,HCl中的Cl化合价升高,作还原剂,表现还原性;还与二氧化锰反应生成盐和水,表现酸性;二氧化锰作氧化剂,HCl作还原剂,根据方程式,化合价降低的Cl原子为2,则氧化剂和还原剂的物质的量之比为1:2;
②NaOH与氯气反应生成氯化钠、次氯酸钠和水,离子方程式为2OH—+Cl2=Cl—+ClO—+H2O;
(4)①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应,随反应的进行,盐酸的浓度减小,到一定程度后则不再反应,生成氯气的物质的量小于2mol;②用87 g 二氧化锰,即1mol与足量浓盐酸反应,若不考虑氯化氢的挥发,可生成2mol氯气,答案为B。


科目:高中化学 来源: 题型:
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
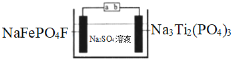
下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)Fe2(SO4)3(写出电离方程式)_____
(2)铝和氢氧化钠溶液混合(写出反应的离子方程式)_____
(3)2H++CO32﹣═H2O+CO2↑(改写成化学方程式)________
(4)除去NaHCO3溶液中混有少量 Na2CO3溶液的离子反应方程式_____.
Ⅱ.有一瓶溶液只含Cl﹣、CO32﹣、SO42﹣、Na+、Mg2+、Cu2+六种离子中的某几种通过实验:
①原溶液![]() 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解.
(1)试分析原溶液中一定含有的离子是_____,一定不含有的离子是_____,
(2)有的同学认为实验③可以省略,你认为是否正确_____(填是或否),理由是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、NH![]() 、Cl-、CO
、Cl-、CO![]() 和SO
和SO![]() 。现每次取10.00 mL进行实验:
。现每次取10.00 mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.672 L (标准状况下);
③第三份加足量BaCl2溶液后得干燥沉淀6.63 g,沉淀经足量盐酸洗涤,干燥后剩4.66 g。
请回答:
(1) c(CO![]() )=____mol·L-1。
)=____mol·L-1。
(2) K+是否存在?_______;若存在,浓度范围是_____(若不存在,则不必回答)。
(3) 根据以上实验:
①不能判断哪些离子是否存在________________;
②若存在这些离子,如何进行检验?_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:
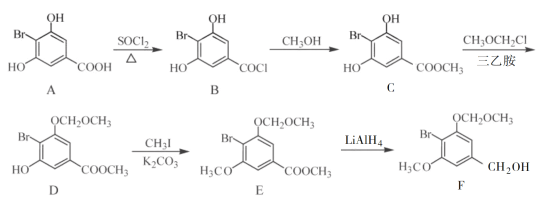
(1)E中含氧官能团的名称为________和________。
(2)B→C的反应类型为________。
(3)C→D反应中会有副产物X(分子式为C12H15O6Br)生成,X的结构简式为:________。反应D→E的方程式为______________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: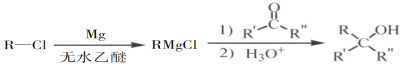 (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以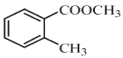 和CH3CH2CH2OH为原料制备的
和CH3CH2CH2OH为原料制备的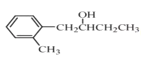 合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________________
合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2![]() 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
A. 1.0体积的N2和3.0体积的H2
B. 2.0体积的N2和6.0体积的H2和4.0体积的NH3
C. 4.0体积的NH3和1.0体积的H2
D. 2.0体积的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)、某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,铝片上的电极的反应式为_________;
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,铝片为____极(填“正”或“负”)。正极上发生的电极反应式为_________;
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为______。
(二)、肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是_______________________________________。肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼一空气燃料电池放电时:正极的电极反应式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.0.1 mol N2的质量是2.8 g
B.常温常压下,22 g CO2中所含氧原子数约为6.02×1023
C.2 L 0.1mol·L-1NaCl溶液中,c(Na+)=0.2mol·L-1
D.标准状况下,11.2 L O2含有的原子数目约为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com