
| A. | 硬度比生铁低 | B. | 在潮湿空气中放置不易生锈 | ||
| C. | 可溶在稀H2S04中 | D. | 熔点比生铁低 |
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲溶液含有Cl- | B. | 乙溶液含有Mg2+ | C. | 丙溶液含有Ba2+ | D. | 丁溶液含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别蘸有浓氨水和浓盐酸的两根玻璃棒靠近时有白烟生成 | |
| B. | 氨气极易溶解于水,因此可用来做喷泉实验 | |
| C. | 氯化铵受热分解有氨气生成,因此实验室可以用加热氯化铵的方法制备氨气 | |
| D. | 氨具有还原性,可以被氧化成NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
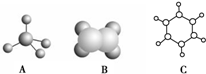 如图中A、B、C分别是三种有机物的结构模型:
如图中A、B、C分别是三种有机物的结构模型:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液中:Na+、NH4+、K+、NO3-、Mg2+ | |
| B. | 使酚酞变红色的溶液中:NH4+、Zn2+、Cl-、NO3- | |
| C. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、SO32- | |
| D. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
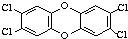 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是( )
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是( )| A. | 此分子中共平面的原子最多有18个 | B. | 它难溶于水 | ||
| C. | 它的一溴取代物只有一种 | D. | 它能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com