
已知反应:CO(g)  C(s) +
C(s) + 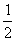 O2(g)的△H为正值,△S为负值。设△H和△S不随温度而变化,下列说法中正确的是( )
O2(g)的△H为正值,△S为负值。设△H和△S不随温度而变化,下列说法中正确的是( )
A.低温下是自发变化
B.高温下是自发变化
C.低温下是非自发变化,高温下是自发变化
D.任何温度下都是非自发变化
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是
A.图Ⅰ中 可以看出反应A(g)=C(g)的△H=(E1-E4)kJ·mol-1
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.图Ⅲ表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D.图Ⅳ曲线表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
在372K时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol/L。在60s时,体系达到平衡,此时容器内的压强为开始时压强的1.6倍。下列说法正确的是 高 考 资 源 网
A 前2s 以N2O4浓度变化表示的平均反应速率为0.01mol/(L.S)
B 在2s时体系内的压强为开始时的1.1倍
C 在平衡体系内含有N2O4 0.25mol D 平衡时N2O4的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z为短周期元素的单质,U、V为它们的化合物,这些物质之间的关系如下所示,其中反应条件和某些产物已经略去:
(1)如果X、Y是同主族元素,写出反应Ⅰ的化学方程式:
 ①若已知V是水:
①若已知V是水:
②若已知U、V均为氧化物:
(2)如果X、Y是不同主族时,按下列要求回答问题。
①X是地壳中含量最多的金属元素时,则X、Y、Z的化学式是:X 、Y 、Z 。
②若Y在自然界中形成的化合物的种类最多时,则U、V的化学式是:U 、V 。
③若Z是通常情况下密度最小的物质,则反应Ⅰ的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,反应aX(g)  bY(g) + cZ(g),达到平衡状态。若把容器的体积压缩到原来的
bY(g) + cZ(g),达到平衡状态。若把容器的体积压缩到原来的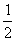 ,达到平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L。下列判断正确的是( )
,达到平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L。下列判断正确的是( )
A.a>b+c B.a=b+c C.a<b+c D.a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,测得0.01mol/L NaOH溶液的PH为11,则该温度下,水的离子积Kw=_____________。在此温度下,将PH= a 的NaOH溶液Va L与PH= b 的硫酸Vb L混合。
①若所得溶液为中性,且a=12,b=2,则Va :Vb = __________________________
②若所得混合液的PH=10,且a=12,b=2,则Va :Vb = ______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO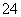 )
)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
A.全部 B.③⑤⑥
C.④⑤⑥ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com