
分析 (1)硅酸盐由盐的书写改写为氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•二氧化硅•水的顺序书写;注意:①氧化物之间以“•”隔开;②系数配置出现的分数应化为整数;③金属氧化物在前(活泼金属氧化物→较活泼金属氧化物),非金属氧化物在后,氧化铝与氢氧化钠溶液作用生成偏铝酸钠和水;
(2)氯气用于漂白时,实际上起漂白作用的物质不是Cl2而是它和水反应生成的次氯酸,缺铁性贫血患者补充的铁,通常以硫酸亚铁的形式,亚铁易被氧化;
(3)从经济角度分析,制取等量的硫酸铜时,所用的原料最少且最便宜的成本最低;从环境保护的角度出发,在制取硫酸铜时最好不要对环境造成污染.
解答 解:(1)硅酸盐改写成氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•SiO2•H2O,同时要遵循原子守恒,普通玻璃中Na2SiO3:CaSiO3:SiO2,其化学式为Na2CaSi6O14,以氧化物的形式表示故写成Na2O•CaO•6SiO2,氧化铝与氢氧化钠溶液作用生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Na2O•CaO•6SiO2;Al2O3+2OH-=2AlO2-+H2O;
(2)氯气用于漂白时,实际上起漂白作用的物质不是Cl2而是它和水反应生成的次氯酸,缺铁性贫血患者补充的铁,通常以硫酸亚铁的形式,亚铁易被氧化,当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是防止Fe2+被氧化,
故答案为:HClO,防止Fe2+被氧化;
(3)A、铜和浓硫酸反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2 ↑+2H2O,该反应中产生有毒气体二氧化硫,所以对环境有污染,不符合“绿色化学”理念,且硫酸的利用率不高,故A错误.
B、铜和稀硫酸不发生反应,不能制得硫酸铜,故B错误.
C、氧化铜和硫酸反应的方程式为:CuO+H2SO4=CuSO4+H2O,没有污染物,且硫酸的利用率100%,符合“绿色化学”和“降低成本”理念,故C正确.
D、铜与Fe(SO4)3溶液反应反应方程式为:Cu+2Fe(SO4)3=CuCl2+2FeCl2,该反应虽有硝酸铜生成,但同时生成氯化铜,不能得到纯净硫酸铜,故D错误.
故答案为:C.
点评 本题考查了物质性质、物质反应现象、物质制备方法等知识,注意基础知识的积累和掌握,题目难度中等.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、NO3-、HCO3-、Na+ | B. | Na+、SO42-、Mg2+、I- | ||
| C. | NO3-、Cu2+、K+、Cl- | D. | H+、K+、ClO-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液与过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4 Fe3++2H2O | |
| D. | CuSO4溶液与少量的Ba(OH)2溶液:Ba2+十SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
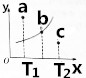 某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:
某温度下的2L密闭容器中发生某一特定反应,3中气体起始状态和平衡状态时的物质的量(n)如下表所示,2s时达到平衡状态.回答下列问题:| 密闭容器 | A | B | C |
| n(起始状态)/mol | 4 | 2 | 0 |
| n(平衡状态)/mol | 2.8 | 1.4 | 1.2 |
| 密闭容器 | 甲 | 乙 | 丙 | 丁 | |
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| A的平衡转化率 | 80 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
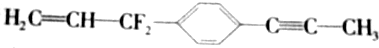 为已知结构,下列叙述中正确的是( )
为已知结构,下列叙述中正确的是( )| A. | 除苯环外的其余碳原子有可能都在同一条直线上 | |
| B. | 在同一平面上的原子最多有19个 | |
| C. | 12个碳原子不可能都在同一个平面上 | |
| D. | 12个碳原子有可能都在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
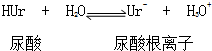 ②Ur-(aq)+Na+(aq)?NaUr(s)
②Ur-(aq)+Na+(aq)?NaUr(s)| A. | 反应的△H>0 | B. | 反应的△H=0 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 降低温度平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com