
分析 加热发生反应Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中Fe无论过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,结合极性法计算气体的质量范围.
解答 解:加热发生反应Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中Fe无论过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,
n(气体)=$\frac{2.24L}{22.4L/mol}$=0.1mol=n(Fe),
则原混合物中铁粉的质量为0.1mol×56g/mol=5.6g,
若气体全为硫化氢,其质量为0.1mol×34g/mol=3.4g,
若气体全为氢气,其质量为0.1mol×2g/mol=0.2g,
则生成气体的质量范围为0.2g<m(气体)<3.4g,
答:原混合物中铁粉的质量为5.6g,生成气体的质量范围0.2g<m(气体)<3.4g.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、气体与铁的物质的量关系、极性法计算等为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1NA个氢气分子所占的体积为22.4L | |
| B. | 2NA个二氧化碳分子的摩尔质量为88g/mol | |
| C. | 1000mL 0.1mol/L的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 17g氨气中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液为浅绿色 | |
| B. | 溶液为棕黄色 | |
| C. | 加入硫氰化钾溶液显红色 | |
| D. | 滴加NaOH溶液,产生白色沉淀,该沉淀放置在空气中不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 霾是一种分散系,分散质是固体 | |
| B. | 雾是一种分散系,分散剂是气体 | |
| C. | 霾属于胶体分散系 | |
| D. | 减少生产生活中产生的扬尘可以减少雾霾天气的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列各种物质,有的具有多个官能团:请填写下列空白(填编号):
下列各种物质,有的具有多个官能团:请填写下列空白(填编号):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
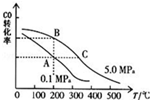 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
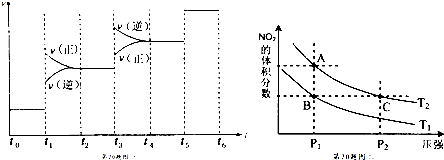
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
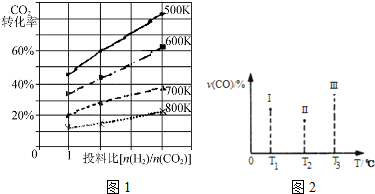
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
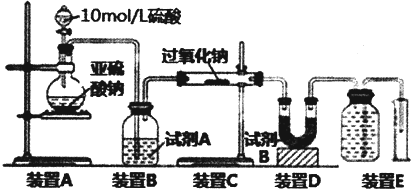
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com