
| A、标准状况下,22.4L SO3中含有的氧原子数为3NA |
| B、标准状况下,22.4L Cl2与足量的稀NaOH 溶液反应,转移电子总数为2NA |
| C、1mol N5+共有34NA核外电子 |
| D、0.5mol CCl4中含有共价键数目为4NA |


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
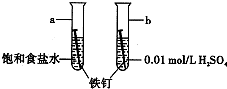 如图是研究铁钉腐蚀的装置图.下列说法不正确的是( )
如图是研究铁钉腐蚀的装置图.下列说法不正确的是( )| A、ab在两处的腐蚀速率a<b |
| B、a、b两处铁钉中的碳均为正极 |
| C、a、b两处铁钉中的铁均失电子被氧化 |
| D、a、b两处的正极反应式均为O2+4e-+4H+═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有化学键断裂的过程一定发生化学变化 | ||
| B、氯化钠是一种电解质,电解饱和食盐水可制得金属钠 | ||
C、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| D、SiO2是酸性氧化物,能与强碱溶液反应,但不与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-) |
| B、相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 |
| C、向0.1mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体 析出 |
蛋白质均发生变性 |
| B | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色 沉淀 |
溶液X中不一定含有SO42- |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色 沉淀 |
H2SiO3的酸性比H2CO3的酸性强 |
| D | 向浓度均为0.1mol?L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色 沉淀 |
Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氧化铝溶于水 |
| B、将氧化铝先溶于盐酸中,之后滴加氨水 |
| C、将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液 |
| D、将氧化铝溶于氢氧化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
| B、绿色化学的核心是从源头上消除工业生产对环境的污染 |
| C、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| D、华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com