
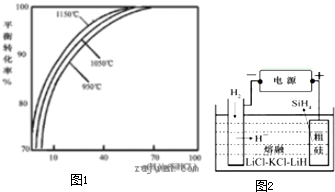
 多晶硅是太阳能光伏产业的重要原料.
多晶硅是太阳能光伏产业的重要原料.| n(H2) |
| n(SiHCl3) |
| 60% |
| 28 |
| 40% |
| 14 |


科目:高中化学 来源: 题型:
| A、混合气体的密度 |
| B、混合气体的总物质的量 |
| C、混合气体的平均相对分子质量 |
| D、体系的温度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
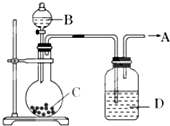 为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃.
为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、不会在空气中燃烧的气体,但能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无法计算 |
| B、0.24mol |
| C、0.42mol |
| D、0.21mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com