
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1L,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是__________,一定存在的阳离子是______________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:_____________________________________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为___________,所得沉淀的最大质量是_________g。
(4)若通过实验确定原废水中c(Na+)=0.18 mol·L-1,试判断原废水中NO3-是否存在?__________(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)=____________ mol·L-1。(若不存在或不确定则此空不填)
【答案】 CO32- Na+、H+、Al3+、 Mg2+、NH4+ NH4+ + OH﹣ = NH3·H2O 2:1 10.7g 存在 0.08
【解析】无色废水中没有Fe3+;根据实验①确定存在Na+,根据实验②确定有SO42-,根据实验③结合图像可知,溶液中有H+、NH4+、Al3+、Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;
根据硫酸钡沉淀93.2g求出n(SO42-)=![]() =0.4mol,根据图像,求出n(Al3+)=n[Al(OH)3]=0.8mol-0.7mol=0.1mol,n(NH4+)=0.7mol-0.5mol=0.2mol和n(H+)=0.1mol,生成,0.1mol氢氧化铝消耗0.3molNaOH,则生成氢氧化镁消耗的氢氧化钠为0.5mol-0.1mol-0.3mol=0.1mol,即含有镁离子0.05mol;根据电荷守恒,阳离子电荷总物质的量=0.1+0.2+0.1×3+0.05×2=0.7mol,阴离子电荷总物质的量=0.4×2=0.8mol,可能含有硝酸根离子,则钠离子至少0.1mol。
=0.4mol,根据图像,求出n(Al3+)=n[Al(OH)3]=0.8mol-0.7mol=0.1mol,n(NH4+)=0.7mol-0.5mol=0.2mol和n(H+)=0.1mol,生成,0.1mol氢氧化铝消耗0.3molNaOH,则生成氢氧化镁消耗的氢氧化钠为0.5mol-0.1mol-0.3mol=0.1mol,即含有镁离子0.05mol;根据电荷守恒,阳离子电荷总物质的量=0.1+0.2+0.1×3+0.05×2=0.7mol,阴离子电荷总物质的量=0.4×2=0.8mol,可能含有硝酸根离子,则钠离子至少0.1mol。
(1)根据上述分析,废水中一定不存在的阴离子是CO32-,一定存在的阳离子是Na+、H+、Al3+、 Mg2+、NH4+,故答案为:CO32-;Na+、H+、Al3+、 Mg2+、NH4+;
(2)实验③图像中沉淀达到最大量且质量不再发生变化的阶段发生反应的离子反应方程式为:NH4++OH-=NH3H2O,故答案为:NH4++OH-=NH3H2O;
(3)根据上述分析,在原溶液中![]() =
=![]() =
=![]() =
=![]() ,沉淀的最多时含有0.1mol氢氧化铝和0.05mol氢氧化镁,质量=0.1mol×78g/mol+0.05mol×58g/mol=10.7g,故答案为:2:1;10.7g;
,沉淀的最多时含有0.1mol氢氧化铝和0.05mol氢氧化镁,质量=0.1mol×78g/mol+0.05mol×58g/mol=10.7g,故答案为:2:1;10.7g;
(4)根据上述分析,若通过实验确定原废水中c(Na+)=0.18 mol·L-1,即含有钠离子0.18mol,则含有NO3-0.08mol,c(NO3-)=![]() =0.08mol·L-1,故答案为:存在;0.08。
=0.08mol·L-1,故答案为:存在;0.08。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组液体混合物,用分液漏斗不能分开的是( ) ①水与煤油 ②氯乙烷和水 ③甲苯和水 ④苯和溴苯⑤苯和甲苯⑥乙醇和水⑦硝基苯和水.
A.①④⑤
B.②③⑥
C.④⑤⑥
D.②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与100mL 18.5molL-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲35.84L(标准状况)。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1 mol/L,下列叙述不正确的是( )
A. 反应中共消耗1.8molH2SO4
B. 气体甲中SO2与H2的体积比为7:1
C. 反应中共消耗1.6molZn
D. 反应中共转移3.2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应 OH﹣+H+=H2O
B.澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O
C.铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断:
(1)写出下列化学式AI
(2)G转化为I的现象为
(3)F+M→H离子方程式为
(4)A+X→C+D的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、P、Q均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行)。
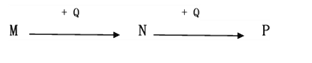
(1)若N的溶液显黄色,一定条件下N的饱和溶液可与沸水反应生成红褐色分散系
①请写出生成红褐色分散系过程中涉及的方程式:_____________________;
②P溶液中加入氢氧化钠溶液的现象:_____________________;
③N与Q转化为P的离子反应方程式:______________;
④一定条件下Q与水反应的化学方程式:_____________________。
(2)若M为NaOH,且P为白色沉淀
①P为______________;
②M与某金属单质也可生成N,该反应的离子方程式______________;
③P溶于M的离子反应方程式_____________________;
④N与Q混合生成白色沉淀的离子反应方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。

已知:①NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②二氧化氯极易溶于水。
(1)装置A中NaClO3和Na2SO3制备ClO2气体,其物质的量的理论比值为____________;该装置中采用浓硫酸而不用稀硫酸的原因是___________。
(2)装置B的作用是 _____________;装置C中反应为放热反应,在不改变反应物浓度和体积的条件下,为了使反应在低温下进行,实验中可采取的措施是________________。
(3)写出装置C发生的离子方程式______________。
(4)从装置C反应后的溶液获得干燥的NaClO2晶体的操作步骤为:将装置C中的液体取出在减压和55℃条件下蒸发,至出现大量晶体后,___________________(填实验步骤)。(已知:NaClO2晶体易溶于水,难溶解于乙醇等有机溶剂。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯 t、苯乙烯 b 及立方烷 c 的分子式均为 C8H8。下列说法正确的是
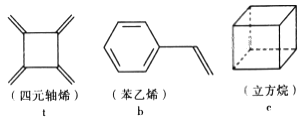
A. b 的同分异构体只有 t 和 c 两种
B. t、b、c 的二氯代物均只有三种
C. t 和b 能使酸性 KMnO4 溶液褪色而c 不能
D. t、b、c 中只有 t 的所有原子处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com