
| A. | 电池放电时,H2参与负极反应,发生氧化反应 | |
| B. | 电池放电时,镍元素被氧化 | |
| C. | 电池放电时,电子从氢气这一极到NiO(OH) 这一极 | |
| D. | 电池充电时,电能转化为化学能 |
分析 氢镍电池的总反应式是$\frac{1}{2}$H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2,放电时,负极反应为:H2-2e-+2OH-=2H2O,正极反应为:NiO(OH)+H2O+e-=OH-+Ni(OH)2,充电时的电极反应为放电时的逆反应,据此分析.
解答 解:A.放电时电池负极反应为H2-2e-+2OH-=2H2O,所以H2参与负极反应,发生氧化反应,故A正确;
B.电池放电时,正极反应为:NiO(OH)+H2O+e-=OH-+Ni(OH)2,镍元素被还原,故B错误;
C.电池放电时,电子从负极氢气这一极到正极NiO(OH) 这一极,故C正确;
D.电池充电时,电能转化为化学能,故D正确.
故选B.
点评 本题考查化学电源新型电池,题目难度不大,注意电极反应式的书写,根据电极反应判断溶液离子浓度的变化.


科目:高中化学 来源: 题型:解答题

 .元素⑨的基态原子的价电子排布式为1s22s22p63s23p63d104s2.
.元素⑨的基态原子的价电子排布式为1s22s22p63s23p63d104s2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中,A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水硫酸铜粉末,D为碱石灰,F为新制的Cu(OH)2悬浊液.(提示:乙醇催化氧化产物与新制Cu(OH)2悬浊液共热有砖红色沉淀生成)
如图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中,A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水硫酸铜粉末,D为碱石灰,F为新制的Cu(OH)2悬浊液.(提示:乙醇催化氧化产物与新制Cu(OH)2悬浊液共热有砖红色沉淀生成)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1 mol HCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10NA | |
| D. | 22.4 L的CO气体与l mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
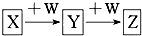 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )| A. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| B. | 若X是金属铝,则W可能是强碱 | |
| C. | 若W是氢氧化钠,则X与Z可能反应生成Y | |
| D. | 若X为氧气,则X与Y的相对分子质量可能相差12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③>①>②>④ | B. | ①>②>③>④ | C. | ②>③>①>④ | D. | ②>①>③>④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com