
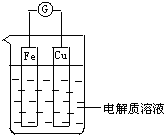
 如图所示,组成一个原电池.
如图所示,组成一个原电池.分析 (1)该装置中铁易失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,Cu作正极,正极上电极反应式为2H++2e-=H2↑,据此分析解答;
(2)Fe在浓硝酸中钝化,铁作为正极,电极反应式为:4H++2NO3-+2e-=2NO2↑+2H2O.
解答 解:(1)①Fe易失电子发生氧化反应而作负极,电极反应式为Fe-2e-=Fe2+,故答案为:负;Fe-2e-=Fe2+;氧化;
②Cu作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:正;2H++2e-=H2↑;还原;
(2)Fe在浓硝酸中钝化,铁作为正极,电极反应式为:4H++2NO3-+2e-=2NO2↑+2H2O,故答案为:正;4H++2NO3-+2e-=2NO2↑+2H2O.
点评 本题考查原电池中电解质溶液对电极的影响,把握住问题的关键就是:负极发生氧化反应,正极发生还原反应即可.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅胶可作袋装食品的干燥剂 | B. | 84消毒液的有效成分是NaClO | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 氢氧化铝可作胃酸的中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “钡餐”中使用的硫酸钡是弱电解质 | |
| B. | 镀锌铁镀层破损后,铁更容易被腐蚀 | |
| C. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| D. | 推广使用太阳能、风能、海洋能、氢能,不利于缓解温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于Ksp(Ag2S)<Ksp(AgI),向含浓度分别为0.01mol/L的S2-与I-的混合溶液中加入足量的AgNO3(s),只有Ag2S沉淀生成 | |
| B. | FeS在水中的溶解度大于在Na2S溶液中的 | |
| C. | 向含有AgCl(s)的饱和AgCl溶液中加水,固体AgCl质量会减少,但AgCl的溶解度与Ksp均不变 | |
| D. | 达到沉淀溶解平衡时,溶液中离子浓度不一定相等但会保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个${\;}_{55}^{137}$Cs含有82个中子 | B. | CsOH的碱性比KOH的强 | ||
| C. | HI的还原性比HF的强 | D. | KIO3是碘的最高价含氧酸的盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
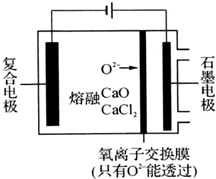 纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:
纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com