
| A. | 原电池中电子流出的一极是正极 | |
| B. | 原电池是将化学能转变为电能的装置 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 原电池放电时,电流的方向是从负极到正极 |
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、MnO2 | B. | 铜片、浓硫酸 | C. | 大理石、硫酸 | D. | 银与硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂 | |
| D. | Y与Z能形成Z2Y和Z2Y2两种不同的化合物,它们的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
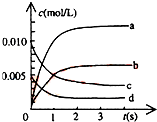 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pt为负极,Zn为正极 | |
| B. | Zn为负极,Pt为正极 | |
| C. | 负极反应式为Zn-2e-═Zn2+,正极反应式为2H++2e-═H2↑ | |
| D. | 负极反应式为Zn-2e-═Zn2+,正极反应式为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
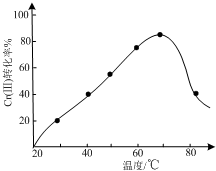 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀.利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com