
| A. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| B. | 为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有三氧化二铁 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将(NH4)2Fe(SO4)2•6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质 |
分析 A.先加入硫氰化钾溶液,溶液不显示红色,说明溶液中不存在铁离子,再加入氯水后变为红色,说明此时溶液中存在铁离子,则原溶液中一定含有亚铁离子;
B.只能证明红砖中含有铁离子,红砖中还可能含有亚铁离子;
C.硫酸亚铁与氢氧化钠溶液反应生成氢氧化铁沉淀;
D.稀硝酸具有强氧化性,能够将亚铁离子氧化,干扰了检验结果.
解答 解:A.向某溶液中加入2滴KSCN溶液,溶液不显红色,说明原溶液中不存在Fe3+,再向溶液中加入几滴新制的氯水,溶液变为红色,说明加入氯水后的溶液中存在铁离子,则证明原溶液中一定存在Fe2+,故A正确;
B.向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中含有铁离子,但无法证明红砖中是否含有亚铁离子,则不能说明红砖中只有三氧化二铁,故B错误;
C.向硫酸亚铁溶液中滴加氢氧化钠溶液,得到的是氢氧化铁沉淀,无法获得氢氧化铁胶体,故C错误;
D.将(NH4)2Fe(SO4)2•6H2O试样溶于稀硝酸中,稀硝酸将亚铁离子氧化成铁离子,干扰了检验结果,应该用稀盐酸,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度不大,涉及铁离子和亚铁离子检验、氢氧化铁胶体的制备、稀硝酸性质等知识,明确常见离子性质及检验方法为解答关键,试题培养了学生的分析能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | C(s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2 | |
| B. | S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)═Ca(OH)2(s)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )
短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )| A. | 元素的非金属性:Y>Z>X | |
| B. | 反应①中消耗lmola时转移电子数与反应②中生成1mol a时转移电子数相等 | |
| C. | 原子半径的大小:y<Z<W | |
| D. | Y的氢化物常温常压下为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子比例模型: | B. | 二 氧化硅的分子式:SiO2 | ||
| C. | 溴化铵的电子式: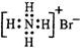 | D. | S2-离子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钌催化剂能加快该反应的速率 | B. | 升高温度能减慢该反应的速率 | ||
| C. | 达到平衡时,CO2能100%转化为CH4 | D. | 达到平衡时,反应速率:v(正)=v(逆)≠0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠具有良好的导电性,密度比水的小 | |
| B. | 钠在空气中最后变为白色的碳酸钠 | |
| C. | Ca(OH)2饱和溶液中加入Na的小颗粒,会析出固体 | |
| D. | 钠在工业上用于制造氯化钠、氢氧化钠、碳酸钠等化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com