
| A£®¢Ū¢Ü¢ß¢ą”” | B£®¢Ł¢Ū¢Ü¢ß¢ą | C£®¢Ł¢Ś¢Ż¢Ž¢į | D£®¢Ł¢Ü¢ß¢į |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 ””
””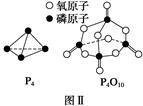
 O2(g)=CO2(g)£«2H2(g)¦¤H£½£192£®9 kJ”¤mol£1
O2(g)=CO2(g)£«2H2(g)¦¤H£½£192£®9 kJ”¤mol£1| »Æѧ¼ü | P”ŖP | P”ŖO | O=O | P=O |
| ¼üÄÜ/kJ”¤mol£1 | a | b | c | x |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

 2CO£«O2””¢Ś2H2O===2H2£«O2””¢Ū2N2£«6H2O
2CO£«O2””¢Ś2H2O===2H2£«O2””¢Ū2N2£«6H2O 4NH3£«3O2””¢Ü2CO2£«4H2O
4NH3£«3O2””¢Ü2CO2£«4H2O 2CH3OH£«3O2””¢Ż2CO£«4H2O
2CH3OH£«3O2””¢Ż2CO£«4H2O ________£«3O2
________£«3O2| ¹²¼Ū¼ü | H”ŖN | H”ŖO | N”ŌN | O===O |
| ¶ĻĮŃ1 mol»Æѧ¼üĖłŠčÄÜĮæ/(kJ”¤mol£1) | 393 | 460 | 941 | 499 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬H2(g)+Cl2(g)£½ 2HCl(g)ŌŚ¹āÕÕĢõ¼žĻĀŗĶµćČ¼Ģõ¼žĻĀµÄ¦¤H²»Ķ¬ |
| B£®³£ĪĀĻĀ£¬2A(s)+B(g)£½ 2C(g)+D(g)²»ÄÜ×Ō·¢½ųŠŠ£¬ŌņøĆ·“Ó¦ģŹ±äŅ»¶Ø“óÓŚĮć |
| C£®1molĮņĖįÓė1molBa(OH)2ĶźČ«ÖŠŗĶĖł·Å³öµÄČČĮæĪŖÖŠŗĶČČ |
| D£®ŌŚ25”ę”¢101KPaŹ±£¬2mol SµÄČ¼ÉÕČČŹĒ1mol SµÄ2±¶ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
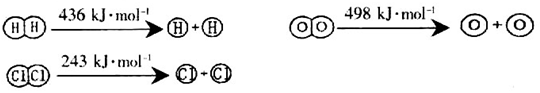
 ,ĖüĖł¶ŌÓ¦µÄ»Æѧ·½³ĢŹ½ĪŖ________________”£
,ĖüĖł¶ŌÓ¦µÄ»Æѧ·½³ĢŹ½ĪŖ________________”£ 2NH3(g) ”÷H£¼0ŌŚ400”ꏱK£½0.5£¬“ĖĢõ¼žĻĀŌŚ0.5LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠøĆ·“Ó¦£¬Ņ»¶ĪŹ±¼äŗ󣬲āµĆN2”¢H2”¢NH3µÄĪļÖŹµÄĮæ·Ö±šĪŖ2mol”¢1mol”¢2mol£¬Ōņ“ĖŹ±·“Ó¦¦Ō(N2)Õż______¦Ō(N2)Äę£ØĢī”°£¾”±”¢”°£¼”±»ņ”°£½”±£©”£ÓūŹ¹µĆøĆ·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹ¼Óæģ£¬Ķ¬Ź±Ź¹Ę½ŗāŹ±NH3µÄĢå»ż°Ł·ÖŹżŌö¼Ó£¬æɲÉČ”µÄ“ėŹ©ŹĒ_______£ØĢīŠņŗÅ£©”£
2NH3(g) ”÷H£¼0ŌŚ400”ꏱK£½0.5£¬“ĖĢõ¼žĻĀŌŚ0.5LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠøĆ·“Ó¦£¬Ņ»¶ĪŹ±¼äŗ󣬲āµĆN2”¢H2”¢NH3µÄĪļÖŹµÄĮæ·Ö±šĪŖ2mol”¢1mol”¢2mol£¬Ōņ“ĖŹ±·“Ó¦¦Ō(N2)Õż______¦Ō(N2)Äę£ØĢī”°£¾”±”¢”°£¼”±»ņ”°£½”±£©”£ÓūŹ¹µĆøĆ·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹ¼Óæģ£¬Ķ¬Ź±Ź¹Ę½ŗāŹ±NH3µÄĢå»ż°Ł·ÖŹżŌö¼Ó£¬æɲÉČ”µÄ“ėŹ©ŹĒ_______£ØĢīŠņŗÅ£©”£ 2C(g)£«D(s) ”÷H£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKÓėTµÄ¹ŲĻµČēĻĀ±ķ£ŗ
2C(g)£«D(s) ”÷H£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKÓėTµÄ¹ŲĻµČēĻĀ±ķ£ŗ| T/K | 300 | 400 | 500 | ”” |
| K/(mol”¤L£1)2 | 4”Į106 | 8”Į107 | 1.2”Į109 | ”” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®H+(aq)+OH-(aq)=H2O(l) ¦¤H=" -a" kJ/mol,¹Ź1 mol NaOH¹ĢĢåÓė×ćĮæµÄĻ”ŃĪĖį·“Ó¦,·Å³öČČĮæĪŖa kJ |
| B£®ŅņCuSO4”¤5H2O(s)=CuSO4(s)+5H2O(l) ¦¤H="+b" kJ/mol£¬¹Ź1 mol CuSO4(s)ČÜÓŚĖ®Ź±,·Å³öČČĮæb kJ |
| C£®ŅņĒāĘųµÄČ¼ÉÕČČĪŖc kJ/mol£¬¹Źµē½āĖ®µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2H2O(l)=2H2(g)+O2(g) ¦¤H="+c" kJ/mol |
D£®ŅņN2(g)+3H2(g)  2NH3(g) ¦¤H=" -" d kJ/mol£¬¹ŹŌŚÄ³ČŻĘ÷ÖŠĶ¶Čė1 mol N2Óė3 mol H2³ä·Ö·“Ó¦ŗ󣬷ųöČČĮæŠ”ÓŚd kJ 2NH3(g) ¦¤H=" -" d kJ/mol£¬¹ŹŌŚÄ³ČŻĘ÷ÖŠĶ¶Čė1 mol N2Óė3 mol H2³ä·Ö·“Ó¦ŗ󣬷ųöČČĮæŠ”ÓŚd kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¼üÄÜŌ½“󣬱ķŹ¾øĆ·Ö×ÓŌ½ČŻŅ׏ÜČČ·Ö½ā |
| B£®¹²¼Ū¼ü¶¼¾ßÓŠ·½ĻņŠŌ |
| C£®ŌŚ·Ö×ÓÖŠ£¬Į½øö³É¼üµÄŌ×Ó¼äµÄ¾ąĄė½Š¼ü³¤ |
| D£®H”ŖClµÄ¼üÄÜĪŖ431.8kJ”¤mol£1£¬H”ŖBrµÄ¼üÄÜĪŖ366kJ”¤mol£1£¬ĖµĆ÷HCl±ČHBr·Ö×ÓĪČ¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ČĪŗĪĒæĖįÓėĒæ¼ī·“Ӧɜ³É1 mol H2OµÄ¹ż³ĢÖŠ£¬·Å³öµÄČČĮæ¾łĻąĶ¬ |
| B£®µČĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢå·Ö±šĶźČ«Č¼ÉÕ£¬ŗóÕ߷ųöČČĮæ¶ą |
| C£®¶ŌÓŚČĪŗĪŅ»øöĪüČČ·“Ó¦£¬Ź¹ÓĆ“ß»Æ¼Įŗ󣬦¤H½«½µµĶ |
| D£®ŅŃÖŖ£ŗO=O¼ü¼üÄÜĪŖa kJ/ mol”¢H£H¼ü¼üÄÜĪŖb kJ/ mol”¢Ė®ÕōĘųÖŠH£O¼üÄÜĪŖc kJ/ mol”£ÓÖÖŖ£ŗH2O(g)= H2O(l)¦¤H=" -d" kJ/ mol”£Ōņ·“Ó¦2H2 (g) + O2(g) = 2H2O(l) µÄ¦¤HĪŖ£ŗ£Øa+2b-4c-2d£©kJ/ mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Šīµē³Ų³äµēŹ±Ęäøŗ¼«Ó¦ÓėĶāµēŌ“µÄµÄÕż¼«ĻąĮ¬½Ó |
| B£®Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬H2(g)+Cl2(g)==2HCl(g)ŌŚ¹āÕÕŗĶµćČ¼Ģõ¼žĻĀµÄ”÷HĻąĶ¬ |
C£®ŅŃÖŖ£ŗH2(g)+I2(g)  2HI(g)£»”÷H =£9.48 kJ/mol£¬Čō½«254g I2(g)ŗĶ2gH2(g)³ä·Ö·“Ó¦æɷųö9.48 kJµÄČČĮæ 2HI(g)£»”÷H =£9.48 kJ/mol£¬Čō½«254g I2(g)ŗĶ2gH2(g)³ä·Ö·“Ó¦æɷųö9.48 kJµÄČČĮæ |
| D£®ŅŃÖŖŌŚ101 kPaŹ±£¬2 gĢ¼Č¼ÉÕÉś³ÉCO·Å³öČČĮæĪŖQ kJ£¬ŌņĢ¼µÄČ¼ÉÕČČĪŖ6Q kJ”¤mol-1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com