
 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图:
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图:分析 由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(3)步骤①滤液中含有Fe2+,加入氢氧化钠生成Fe(OH)2,Fe(OH)2不稳定,可被氧化生成Fe(OH)3;
(4)洗涤沉淀,可使蒸馏水缓慢自然从过滤器中流出,注意不能搅拌;
(5)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答 解:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+,
故答案为:氯水或双氧水;溶液由浅绿色变成血红色;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,可加入氢氧化钠或氨水,反应离子方程式为Fe3++3OH-═Fe(OH)3↓或Fe3++3NH3.H2O═Fe(OH)3↓+3NH4+,
故答案为:氢氧化钠溶液或氨水;Fe3++3OH-═Fe(OH)3↓或Fe3++3NH3.H2O═Fe(OH)3↓+3NH4+;
(4)洗涤沉淀的操作方法是:将蒸馏水沿玻璃棒缓缓加入过滤器中,使蒸馏水缓慢流出,主要不能搅拌,充分2~3次,
故答案为:将蒸馏水沿玻璃棒缓缓加入过滤器中,使蒸馏水缓慢流出,主要不能搅拌,充分2~3次;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量$\frac{ag×\frac{112}{160}}{10}$=0.07ag,
故答案为:0.07a.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 核外电子排布相同的微粒化学性质也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4 L NO与11.2 L O2混合后所得气体分子数为6.02×1023 | |
| B. | 标准状况下3.36 L CCl4含碳原子数为0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含电子数为9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的盐酸中所含氯化氢分子数为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
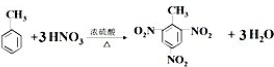
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入相同物质的量浓度的盐酸 | B. | 加入相同物质的量浓度的硝酸 | ||
| C. | 加入相同物质的量浓度的硫酸 | D. | 加入少量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液,看紫红色是否褪去 |
| C | 分离Br2和CCl4混合物 | 向混合物中加入蒸馏水,然后分液 |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com