
科目:高中化学 来源: 题型:选择题
| A. | NO2能支持燃烧 | |
| B. | NO2不能支持燃烧 | |
| C. | 木条复燃是因为硝酸铜分解产生了氧气的缘故 | |
| D. | 木条复燃是因为硝酸铜分解产生了CuO催化作用的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大单位体积内分子的总数,从而成千上万倍地增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
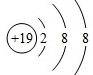 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
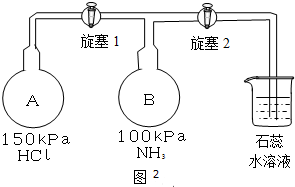
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用10ml量筒量取7.5ml稀盐酸 | |
| B. | 用托盘天平称取25.20gNaCl晶体 | |
| C. | 用蒸发结晶的方法由硫酸铜溶液制取蓝帆 | |
| D. | 用100ml容量瓶配置0.5mol/l的Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com