
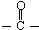 )的化合物反应生成醇,其过程可表示如下:
)的化合物反应生成醇,其过程可表示如下: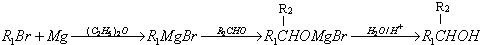 (-R1、-R2表示烃基)
(-R1、-R2表示烃基)
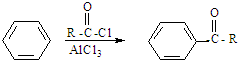
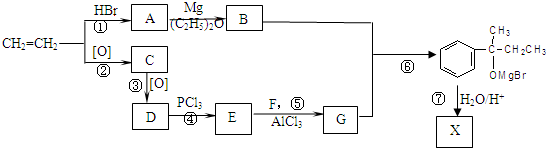
 在酸性条件下水解生成X,结合反应信息可知则X的结构简式为:
在酸性条件下水解生成X,结合反应信息可知则X的结构简式为: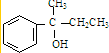 ;乙烯与HBr反应生成A,则A为CH3CH2Br,A按照信息①与Mg反应生成B,则B为CH3CH2MgBr;B与G反应生成
;乙烯与HBr反应生成A,则A为CH3CH2Br,A按照信息①与Mg反应生成B,则B为CH3CH2MgBr;B与G反应生成 ,则G的结构简式为
,则G的结构简式为 ,则F为
,则F为 ;
; 与E生成G,根据信息③可知E的结构简式为
与E生成G,根据信息③可知E的结构简式为 ;D按照信息②反应生成
;D按照信息②反应生成 ,则D为CH3COOH,则C为乙醛:CH3CHO,据此进行解答.
,则D为CH3COOH,则C为乙醛:CH3CHO,据此进行解答. 在酸性条件下水解生成X,结合反应信息可知则X的结构简式为:
在酸性条件下水解生成X,结合反应信息可知则X的结构简式为: ;乙烯与HBr反应生成A,则A为CH3CH2Br,A按照信息①与Mg反应生成B,则B为CH3CH2MgBr;B与G反应生成
;乙烯与HBr反应生成A,则A为CH3CH2Br,A按照信息①与Mg反应生成B,则B为CH3CH2MgBr;B与G反应生成 ,则G的结构简式为
,则G的结构简式为 ,则F为
,则F为 ;
; 与E生成G,根据信息③可知E的结构简式为
与E生成G,根据信息③可知E的结构简式为 ;D按照信息②反应生成
;D按照信息②反应生成 ,则D为CH3COOH,则C为乙醛:CH3CHO,
,则D为CH3COOH,则C为乙醛:CH3CHO, ,
, ;
; ;
; ,
, ;
; .
.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
| A、鼓励使用太阳能、风能等清洁能源能减少PM2.5的污染 |
| B、与铜质水龙头连接处的钢质水管易发生腐蚀 |
| C、发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔 |
| D、金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28g |
| B、常温下,1L0.1mol.L-1的NH4NO3溶液中NH4+和NO3-总数为0.2NA |
| C、标准状况下,4.48 L重水(D20)含有的中子数为2NA |
| D、1 mol甲基(-CH3)所含电子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 滴定法是一种用于测定的非常重要的方法.
滴定法是一种用于测定的非常重要的方法.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |



查看答案和解析>>
科目:高中化学 来源: 题型:
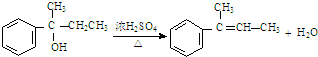
 有机物A是一种重要化工生产的中间体,已知结构简式如图所示:
有机物A是一种重要化工生产的中间体,已知结构简式如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com