
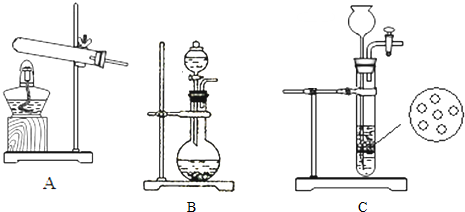
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 反应的化学方程式为 ① | |
| 乙小组 | 浓氨水、氢氧化钠固体 | 氢氧化钠的作用:氨水中存在平衡:NH4++OH-?NH3?H2O?NH3+H2O,NaOH固体溶于水,使溶液中c(OH-)增大,平衡向右移动,且NaOH固体溶于水时放热,溶液温度升高,平衡向右移动. |
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
| ||
| ||
| 0.1980×V×10-3 |
| 10.00×10-3 |
| 0.1980×V×10-3 |
| 10.00×10-3 |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
| A、m-n=b-a |
| B、元素原子序数a>b>c>d |
| C、元素非金属性:R>Z |
| D、最高价氧化物对应水化物的碱性X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、Cu2+、NO3-、Na+ |
| B、Ba2+、Mg2+、Cl-、SO42- |
| C、Na+、Ca2+、Cl-、CO32- |
| D、K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
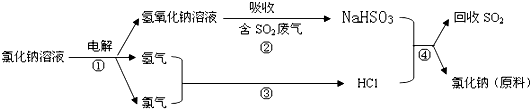
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
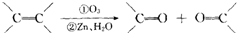 ,这两步反应合称为“烯径的臭氧化分解”.又知结构为R-CO-X(名叫酰卤)的有机物可发生如下的反应:R-CO-X+H2O→R-CO-OH+HX
,这两步反应合称为“烯径的臭氧化分解”.又知结构为R-CO-X(名叫酰卤)的有机物可发生如下的反应:R-CO-X+H2O→R-CO-OH+HX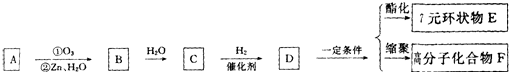
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol NH4+ 所含质子数为10NA |
| B、常温常压下,11.2L氢气含有NA 个氢原子 |
| C、标准状况下,22.4 L H2O所含的分子数为NA |
| D、常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com