
分析 根据浓缩过程中碳酸钠的质量不变计算原溶液的质量,结合质量分数计算碳酸钠的质量,再根据c=$\frac{n}{V}$计算浓缩后碳酸钠溶液的物质的量浓度.
解答 解:假设5.3%的Na2CO3溶液的质量为mg,则:
mg×5.3%=(mg-60g)×15.9%,
解得:m=90g
故碳酸钠的质量为:90g×5.3%=4.77g,其物质的量为:$\frac{4.77g}{106g/mol}$=0.045mol,
则浓缩后碳酸钠溶液的物质的量浓度为:$\frac{0.045mol}{0.02L}$=2.25mol/L,
答:浓缩后Na2CO3溶液的物质的量浓度为2.25mol/L.
点评 本题考查溶液浓度有关计算,涉及质量分数、物质的量浓度的计算,题目难度不大,明确质量分数、物质的量浓度的概念及表达式为解答关键,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| 化学键 | H-Cl | O═O | Cl-Cl | H-O |
| E/(kJ•mol-1) | 431 | 397 | a | 465 |
| A. | 242 | B. | 303.5 | C. | 180.5 | D. | 365 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与硫酸溶液反应:Cu2++2H+═Cu2++H2O | |
| B. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++H2O+CO2↑ | |
| C. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | 钠投入到水中:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0且△S>0的反应肯定是不自发的 | B. | △H<0且△S<0的反应肯定是自发的 | ||
| C. | △H>0且△S>0的反应肯定是自发的 | D. | △H<0且△S>0的反应肯定是自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
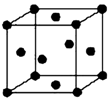 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
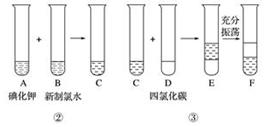
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分类组合 | 碱 | 酸 | 盐 | 氧化物 |
| A | Na2CO3 | H2SO4 | NaCl | CO2 |
| B | NaOH | HCl | NaHCO3 | H2SiO3 |
| C | NaOH | H2CO3 | CaCl2 | SO2 |
| D | KOH | NaHSO4 | CaCO3 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com