
����Ŀ������֮��ı仯�����˻�ѧ֮����
(1)һ�������£�����Ԫ�ص����ʿɷ�����ͼ��ʾ��ѭ��ת����
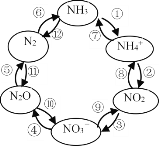
��.ͼ�����ڡ����Ĺ̶�������_______(����ţ���ͬ)��ת�������з�����������ԭ��Ӧ����_______________��
��.��Ӧ������������������NO3����þ����ʵ�֣���÷�Ӧ�����ӷ���ʽΪ_______��
(2)H2S������CuCl2��FeCl3��Һ����һϵ�з�Ӧ��ͼ��ʾ��
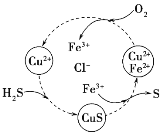
��ת��ͼ�л��ϼ۲����Ԫ����__________(д����)��
��ת��ͼ������S���ʵ����ӷ���ʽΪ____________��
(3)A��B��C��D��E��F��X����ѧ���������������ͼת����ϵ(����������ͷ�Ӧ������ȥ)��
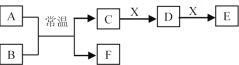
����AΪ�����Ľ������ʣ���ɫ��Ӧ�ʻ�ɫ��B������ΪҺ̬��X��ʹƷ����Һ��ɫ����C��E��Ӧ�����ӷ���ʽΪ________��
����DΪ�����������FΪ�ǽ������ʣ���X�ɷֿ���Ϊ____(д��ѧʽ����ͬ)��
����AΪ����ɫ���壬XΪ�������ʣ���ҺD�м���KSCN��Һ��졣��EΪ______��FΪ______��
���𰸡��� �ٺ͢� 4Mg+2NO3-+10H+=4Mg2++N2O��+5H2O ͭ���⡢�� CuS+2Fe3+=2Fe2++Cu2++S�� OH-+HSO3-=SO32-+H2O HCl��NaOH Fe(NO3)2 NO
��������
(1)I��������̬�ĵ�(������)ת��Ϊ����̬�ĵ�(�����Ļ�����)�Ĺ��̣��������Ĺ̶���ͼ�����ڡ����Ĺ̶������Ǣͣ���������ԭ��Ӧ��ָ�仯������Ԫ�ػ��ϼ۲���ķ�Ӧ��ת�������з�����������ԭ��Ӧ���ǣ��ٺ͢ߣ�
��Ӧ������������������NO3-��þ����ʵ�֣���Ӧ����Mg2+��N2O��H2O�����ӷ���ʽΪ��4Mg+2NO3-+10H+=4Mg2++N2O��+5H2O��
(2)��H2S��Cu2+��Ӧ�õ�CuS��H+��Fe3+��CuS�����õ�S��Cu2+��Fe3+����ԭ��ΪFe2+��O2��Fe2+������ΪFe3+��ͼ��O��Fe��S���ϼ۷����仯����Cu��H��Cl�Ļ��ϼ۲��䣬����ת����ϵͼ��δ������̬�仯��Ԫ��Ϊͭ���⡢�ȣ�
��ת��ͼ�У�Fe3+��CuS�����õ�S��Cu2+��Fe3+����ԭ��ΪFe2+����Ӧ�����ӷ���ʽΪ��CuS+2Fe3+=2Fe2++Cu2++S����
(3)����AΪ�����Ľ������ʣ���ɫ��Ӧ�ʻ�ɫ����AΪNa��BΪH2O��X��ʹƷ����Һ��ɫ��������C������Ӧ��CΪNaOH��XΪSO2��DΪNa2SO3��EΪNaHSO3��FΪH2��C��E��Ӧ�����ӷ���ʽΪ��OH-+HSO3-=SO32-+H2O��
����DΪ�����������FΪ�ǽ������ʣ�A��B�ķ�Ӧ������Al�����ᷴӦ��Al��NaOH��Һ��Ӧ�ȣ���FΪH2��CΪ���Σ�XΪ�DΪAl(OH)3��EΪƫ�����Σ�����FΪH2��CΪƫ�����Ρ�XΪ�ᡢDΪAl(OH)3��EΪ���Σ�X�ɷֿ���ΪHCl��NaOH�ȣ�
����AΪ����ɫ���壬XΪ�������ʣ���ҺD�м���KSCN��Һ��죬��D�к���Fe3+��C����ǿ�����ԣ�����AΪNO2��BΪˮ��CΪHNO3��FΪNO��DΪFe(NO3)3��EΪFe(NO3)2��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����11�֣�����ˮ������������SMR���Ǵ�ͳ��ȡ������������Ҫ���������й��ռ��ɱ��͵��ŵ㡣�ش��������⣺
��1����֪1000 Kʱ�����з�Ӧ��ƽ�ⳣ���ͷ�Ӧ�ȣ�
��CH4(g) ![]() C(s)+2H2(g) K1=10.2 ��H1
C(s)+2H2(g) K1=10.2 ��H1
��2CO(g) ![]() C(s)+CO2(g) K2=0.6 ��H2
C(s)+CO2(g) K2=0.6 ��H2
��CO(g)+H2O(g) ![]() CO2(g)+H2(g) K3=1.4 ��H3
CO2(g)+H2(g) K3=1.4 ��H3
��CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) K4 ��H4��SMR����1000 Kʱ��K4=____________����H4=_________������H1����H2����H3����ʾ����
CO2(g)+4H2(g) K4 ��H4��SMR����1000 Kʱ��K4=____________����H4=_________������H1����H2����H3����ʾ����
��2���ڽ��������װ��ǰ����Ҫ��ԭ�����������������ʹ��Ũ��Ϊ0.5 ppm���¡������Ŀ��Ϊ______________��
��3����ͼΪ��ͬ�¶������µ���ǿ�ȶ�CH4ת���ʵ�Ӱ�졣��ͼ��֪�������Բ�ͬ��������ͬ�¶������µļ���ˮ������������Ӧ�����Ŵٽ����ã������֪��H4____0������>������<������
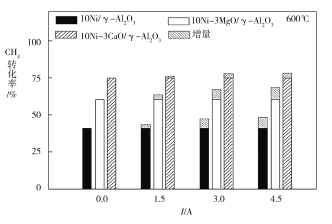
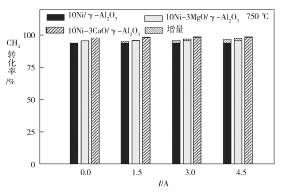
��4����ͼΪ��ͬ�¶�������6Сʱ�ȶ����Ե���ǿ�ȶ�H2���ʵ�Ӱ�졣��ͼ��֪�������¶ȵĽ��ͣ�������H2���ʵ�Ӱ��������____________����������������С����������������600 ��ʱ�����������ִ����е�____________����ͼ�еĴ�����ʾʽ�ش�Ӱ��Ч����Ϊ���������¶ȸ���750 ��ʱ�����۵���ǿ�ȴ�С����������H2����������ͬ����ԭ����______________��

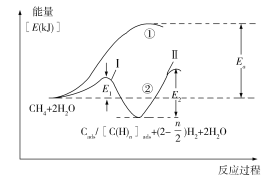
��5���ҹ���ѧ�ҶԼ����ˮ������������Ӧ����Ҳ�����˹㷺�о���ͨ����Ϊ�÷�Ӧ���������С���һ����CH4���ѽ�����H2��̼����̼�����֣�������̼����̼�����֣������ڴ����ϣ���CH4��Cads/[C(H)n]ads+(2�C![]() )H2���ڶ�����̼����̼�����֣���H2O��Ӧ����CO2��H2����Cads/[C(H)n]ads +2H2O��CO2 +(2+
)H2���ڶ�����̼����̼�����֣���H2O��Ӧ����CO2��H2����Cads/[C(H)n]ads +2H2O��CO2 +(2+![]() )H2����Ӧ���̺������仯��ͼ���£����̢�û�мӴ��������̢ڼ�������������̢ٺ͢���H�Ĺ�ϵΪ����_______�ڣ�����>����<�������������������������̢ڷ�Ӧ���ʵ��ǵ�_______������ԭ��Ϊ____________________________��
)H2����Ӧ���̺������仯��ͼ���£����̢�û�мӴ��������̢ڼ�������������̢ٺ͢���H�Ĺ�ϵΪ����_______�ڣ�����>����<�������������������������̢ڷ�Ӧ���ʵ��ǵ�_______������ԭ��Ϊ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij�¶ȣ�t����ʱ�����0.01mol/L��NaOH��Һ��pH=11������¶���ˮ��KW=_______���ڴ��¶��£���pH=a��NaOH��ҺVa L��pH=b��H2SO4��ҺVb L��ϣ������û��ҺΪ���ԣ���a+b=12����Va��Vb=___________��
��2��25��ʱ��0.1mol/L��HaA��Һ��c(H+)/c(OH-)=1010����ش��������⣺
��HaA��___________������ǿ������������������������
���ڼ�ˮϡ��HaA��Һ�Ĺ����У�����ˮ�������Ӷ��������__________������ĸ��
A��c(HaA) B��c(H+)/c(HaA) C��c(H+)��c(OH-)�ij˻� D��c(OH-)
��NanA��Һ��__________�����������������������������������������ǣ������ӷ���ʽ��ʾ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25 ��ʱ����AgCl�İ�ɫ����Һ�У����μ����Ũ�ȵ�KI��Һ��Na2S��Һ���۲쵽���������ȳ��ֻ�ɫ���������ճ��ֺ�ɫ��������֪�й����ʵ��ܶȻ�Ksp(25 ��)�����ʾ��
AgCl | AgI | Ag2S | |
Ksp | 1.8��1010 | 8.3��1017 | 6.3��1050 |
���������������
A.����ת����ʵ�ʾ��dz����ܽ�ƽ����ƶ�
B.�ܽ��С�ij�������ת��Ϊ�ܽ�ȸ�С�ij���
C.AgCl�����ڵ����ʵ���Ũ�ȵ�NaCl��CaCl2��Һ�е��ܽ����ͬ
D.25 ��ʱ���ڱ���AgCl��AgI��Ag2S��Һ�У�����Ag+��Ũ�Ȳ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п��һ�ֶ���Ե����������ϡ�ijС���Դ�����п��������ͭ�������Ϊԭ��ģ�ҵ������������п��������ͼ��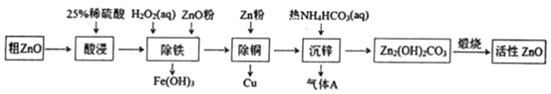
��֪��������������pH��Χ�����ʾ
Zn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ���� | 5.4 | 7.0 | 2.3 | 4.7 |
��ȫ���� | 8.0 | 9.0 | 4.1 | 6.7 |
����˵������ȷ���ǣ� ��
A.���������25%ϡ�������98%Ũ�������ƣ��貣�������ձ�������ͷ�ιܵ�����
B.������������ZnO�۵�����ҺpH��4.1��4.7
C.����ͭ���м���Zn�۹������Ʊ���������п�IJ���û��Ӱ��
D.����п����ӦΪ2Zn2++4HCO3���TZn2��OH��2CO3��+3CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ�����������Һ(Ũ��Ϊ0.2812mol/L)�ⶨδ֪Ũ�ȵ�������Һ��
(1)д����ѧ����ʽ��____________
(2)�ζ�ʱ����_________��ָʾ��������Һ��___ɫ���___ɫ����0.5min����ʱ�ﵽ�ζ��յ㡣
(3)ȡ20.00mL����������Һ���ζ��յ�ʱ�����ı���������30.00mL������������Һ��Ũ��Ϊ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������������������ԭ�����͵���
A. ����FeCl3��Һ
����FeCl3��Һ
B. ��ˮ��̶ȱȽ�
��ˮ��̶ȱȽ�
C. ̽��ʯ��ʯ��ϡ�������ܱջ����µķ�Ӧ
̽��ʯ��ʯ��ϡ�������ܱջ����µķ�Ӧ
D. ±����������ת��
±����������ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
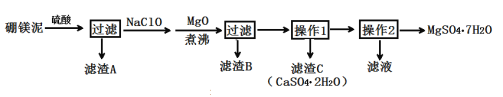
����Ŀ����ˮ����þ��MgSO4��7H2O����ӡȾ����ֽ��ҽҩ�ȹ�ҵ������Ҫ����;����þ������þ��������ɰ�ķ���������Ҫ�ɷ���MgCO3��������MgO��CaO��Fe2O3��FeO��MnO2��Al2O3��SiO2�����ʣ���ҵ������þ����ȡ��ˮ����þ�Ĺ���������ͼ��
��֪����MnO2������ϡ���ᡣ
��CaSO4��MgSO4��7H2O�ڲ�ͬ�¶��µ��ܽ�ȣ�g���������±���ʾ��
�¶�/�� ���� | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4��7H2O | 30.9 | 35.5 | 40.8 | 45.6 | ���� |
��1����ʼ�õ��������������Ϊ70%���ܶ�Ϊ1.61g/cm3�����������Һ�����ʵ���Ũ��Ϊ___��
��2������A�г�������CaSO4��2H2O�⣬����___��
��3������MgO������е�Ŀ����___��
��4��������B����Ҫ�ɷ�ΪAl(OH)3��Fe(OH)3�������NaClO����������ԭ��Ӧ�����ӷ���ʽΪ___��
��5�������в���1Ϊ����Ũ�������ȹ��ˣ��������ɵõ�CaSO4��2H2O���ַ�ֹ___��
��6����ȡMgSO4��7H2O�IJ���2Ϊ��___��___������ϴ�ӡ�
��7����֪��ʼ��þ����Ʒ������Ϊag����ȡ��ˮ����þ������Ϊbg���ݴ��ܼ������þ����þԪ�صĺ��������ܣ���д������ʽ�������ܣ���˵�����ɡ�___���ܻ��ܣ�������ʽ�������ɣ�Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ�з�Ӧ�����Ʊ�SiH4��һ�ַ������丱����MgCl2��6NH3�����ʵ�þ��Դ������˵���������
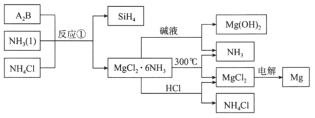
A.A2B�Ļ�ѧʽΪMg2Si
B.�������п���ѭ��ʹ�õ�������NH3��NH4Cl
C.����MgCl2��6NH3��ȡþ�Ĺ����з����˻��Ϸ�Ӧ���ֽⷴӦ
D.�ֱ�MgCl2��Һ��Mg(OH)2����Һ���ȡ����գ����յõ��Ĺ�����ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com