
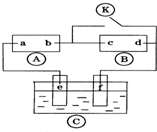
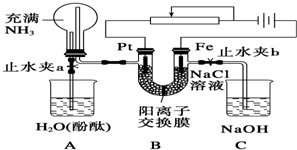
 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通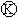 后,下列叙述正确的是( )
后,下列叙述正确的是( )| A. | a为直流电源的负极 | B. | d极发生的反应为2H++2e-═H2↑ | ||
| C. | e极发生氧化反应 | D. | f电极为锌板 |
分析 A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀锌,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,以此解答该题.
解答 解:A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后发现B上的c点显红色,
则c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,d电极上氯离子放电生成氯气,则a是直流电源正极,b是直流电源负极;
为实现铁上镀锌,接通K后,使c、d两点短路,e是电解池阳极,f是阴极,电镀时,镀层作阳极,镀件作阴极,
A.通过以上分析知,a是直流电源正极,故A错误;
B.接通K前,c极为电解池阴极,d为阳极,c电极上氢离子放电生成氢气,则c极发生的反应为2H++2e-═H2↑,故B错误;
C.e电极是阳极,阳极上失电子发生氧化反应,故C正确;
D.为实现铁上镀锌,锌作阳极,铁作阴极,所以e电极为锌板,故D错误.
故选C.
点评 本题综合考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合应用的考查,题目难度中等,注意把握电极方程式的书写和判断.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
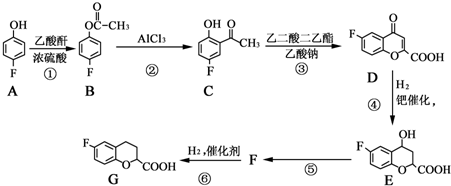
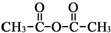
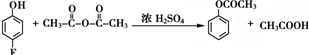 .
.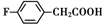 、
、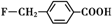
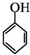 和乙酸酐为原料制备
和乙酸酐为原料制备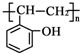 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
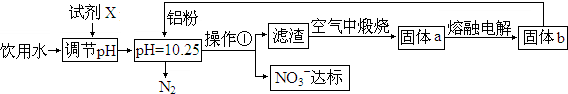
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH4+含有的电子数为11NA | |
| B. | NH4+中N元素的化合价为-3,在氧化还原反应中常作氧化剂 | |
| C. | 0.1 L 3 mol•L-1的NH4NO3溶液中氮原子数等于0.6NA | |
| D. | 硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
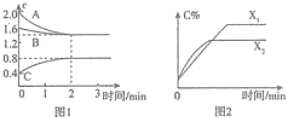
| A. | 0~2分钟、2~3分钟内用A浓度表示的平均反应速率:v(0~2)>v(2~3)>0 | |
| B. | 容器中发生的反应可表示为:3A(g)+B(g)?2C(g) | |
| C. | 若X表示温度,则生成C的反应是放热反应 | |
| D. | 若其他条件不变,仅减小起始时B的浓度,开始反应后C物质的浓度一定减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com