
硅、硫、钠、铁、铝、铜等元素及其化合物在日常生活和生产中应用广泛,回答下列问题:
(1)Si元素在周期表中的位置是 , Na2S的电子式为 。
(2)H2S 、H2O 、SiO2、Na2O熔沸点由高到低的顺序为 。(用化学式表示)
(3)工业上常用氯化铁溶液腐蚀铜制电路板,反应的离子方程式是 。
要从上述腐蚀液中获得较纯的CuCl2溶液,需要将杂质 FeCl3和FeCl2除去,首先将Fe2+氧化成Fe3+,再向溶液中加入 (填化学式),最后过滤。
(4)在CuSO4溶液中通入过量的NH3,小心蒸发,最终得到[ Cu(NH3)4]SO4 晶体,晶体中含有的化学键除普通的共价键外,还含有 。
(5)将4.6g Na和8.1gAl组成的混合物投入到足量的水中,生成H2在标准状况下的体积为 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
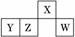 短周期元素X、Y、Z、W在元素周期表中的相对位置如图,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液显酸性
C.简单氢化物的热稳定性:Z>W
D.X与氢元素组成的化合物XH5与水反 应可产生两种气体
应可产生两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物( )
A.所含公用电子对数目为(a/7+1)NA
B.所含碳氢键数目为aNA/7
C.燃烧时消耗的O2一定是33.6 a/14 L
D.所含原子总数为aNA/14
查看答案和解析>>
科目:高中化学 来源: 题型:
下列浓度关系正确的是( )
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B. 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO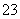 )>c(OH-)>c(HCO
)>c(OH-)>c(HCO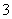 )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.CH3COOH与CH3COONa混合溶液中,一定有c(CH3COO-) >c(Na+)
B.向新制氯水中加入CaCO3可使溶液中HClO浓度增大
C.AgCl在200ml 0.1mol/LNaCl中的溶解度小于在50ml 0.1mol/LMgCl2中溶解度
D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
查看答案和解析>>
科目:高中化学 来源: 题型:
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
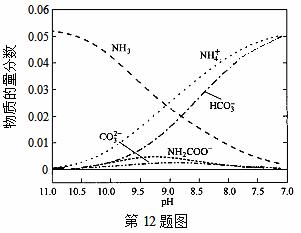
A.在pH=9.0时,c(NH4+)>c(HCO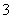 )>c(NH2COOˉ)>c(CO32-)
)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,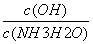 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
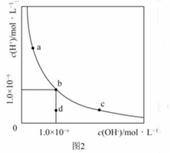 一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说法正确的是( )
一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说法正确的是( )
A.升高温度,可能引起有c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
A.K2SO4 B.CH3COONa C.CuSO4 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是( )
A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com