
| A、0.2 mol/L |
| B、0.25 mol/L |
| C、0.45 mol/L |
| D、0.225 mol/L |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |


科目:高中化学 来源: 题型:
| A、常温常压下,32gO2和O3的混合气体所含原子数为2NA |
| B、1.8g重水(D2O)中含NA个中子 |
| C、标准状况下11.2L乙醇中含0.5NA个乙醇分子 |
| D、8gCuSO4 溶于水中配成0.1mol/L的溶液500ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铜与盐酸、氢氧化铜与醋酸 |
| B、氯化钡溶液与硫酸铜溶液、氢氧化钡溶液与硫酸铜溶液 |
| C、氢氧化钡与稀硫酸、氢氧化钡与稀盐酸 |
| D、石灰石与稀硝酸、石灰石与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
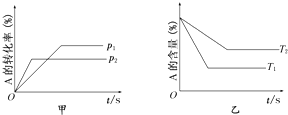
| A、p1<p2 T1>T2 |
| B、减小压强,正逆反应速率都减小,平衡右移 |
| C、△H>0△S>0 |
| D、升高温度,混合气体的平均摩尔质量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
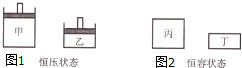 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g),其正反应放热.图1、图2表示起始时容器甲、丙体积都V,容器乙、丁体积都是
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g),其正反应放热.图1、图2表示起始时容器甲、丙体积都V,容器乙、丁体积都是| V |
| 2 |
| A、图1达平衡时,浓度c(SO2):甲=乙 |
| B、图1达平衡时,平衡常数K:甲>乙 |
| C、图2达平衡时,所需时间t:丙<丁 |
| D、图2达平衡时,体积分数φ(SO3):丙>丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com