
| 离子 | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| 浓度/mol•L-l | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

 .
. 分析 (1)根据溶液中电荷守恒计算;
(2)①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
②若n(NO):n(NO2)>1:1,则一氧化氮过量,若<1:1,则二氧化氮过量;
(3)根据图象知,反应物的物质的量变化量一个为(4-1)mol=3mol、一个为(2-0.5)mol=1.5mol,生成物的物质的量变化量一个为(3-0)mol=3mol、一个为(0.75-0)mol=0.75mol,则反应物、生成物的物质的量变化量之比等于其计量数之比=3mol:1.5mol:3mol:0.75mol=4:2:4:1,根据C原子守恒知,计量数是4的为CO、CO2,二氧化硫的计量数是2,硫单质的计量数是1,则生成的硫单质为S2,根据反应物、生成物书写方程式;
(4)由电池装置图可知,Cu上二氧化碳得电子生成甲烷;
(5)芳香烃X的相对分子质量为l06,设其分子式为CxHy,由$\frac{106}{12}$=8…10,可知分子式为C8H10,分子中含有一个苯环,为苯的同系物,核磁共振氢谱中有2个峰,可知分子中含有2种环境的H,应含有2个甲基且处于对位位置.
解答 解:(1)溶液电荷守恒:C(K+)+C(NH4+)+c(Na+)+C(H+)=2C(SO42-)+C(NO3-)+C(Cl-)+c(OH-)和KW,得C(H+)=1×10-4mol•L-1,pH值为4,
故答案为:4;
(2)①该反应中的反应热=反应物的键能和-生成物的键能和=(946+498)kJ/mol-2×630kJ/mol=+184kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
故答案为:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
②若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高;
故答案为:产品Ca(NO2)2中Ca(NO3)2含量升高;排放气体中NO含量升高;
(3)根据图象知,反应物的物质的量变化量一个为(4-1)mol=3mol、一个为(2-0.5)mol=1.5mol,生成物的物质的量变化量一个为(3-0)mol=3mol、一个为(0.75-0)mol=0.75mol,则反应物、生成物的物质的量变化量之比等于其计量数之比=3mol:1.5mol:3mol:0.75mol=4:2:4:1,根据C原子守恒知,计量数是4的为CO、CO2,二氧化硫的计量数是2,硫单质的计量数是1,则生成的硫单质为S2,所以反应方程式为4CO+2SO2=4CO2+S2,故答案为:4CO+2SO2=4CO2+S2;
(4)由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O;故答案为:CO2+8e-+8H+=CH4+2H2O;
(5)芳香烃X的相对分子质量为l06,设其分子式为CxHy,由$\frac{106}{12}$=8…10,可知分子式为C8H10,分子中含有一个苯环,为苯的同系物,核磁共振氢谱中有2个峰,可知分子中含有2种环境的H,应含有2个甲基且处于对位位置,则X的结构简式为 ,
,
故答案为: .
.
点评 本题考查了电解质溶液中的电荷守恒、反应热=反应物的键能和-生成物的键能和、原电池原理、氧化还原反应、化学方程式计算、化学反应原理在工艺流程、有机物结构的确定的应用,氧化还原反应分析等知识,题目难度不大.


科目:高中化学 来源: 题型:解答题
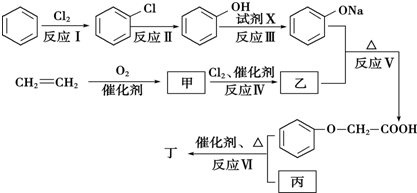
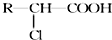
 .
.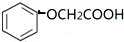 )有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有
)有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有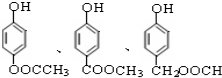 (其中两种)(任写两种即可).
(其中两种)(任写两种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
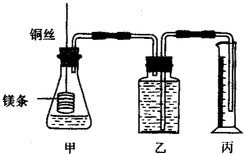 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
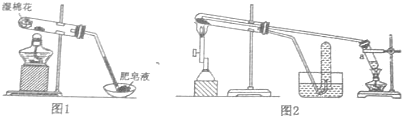
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到的黑色固体X,取出少量放人另一试管中,加人少量盐酸,微热 | 黑色粉末逐渐溶解,产生少量气泡 |
| Ⅱ | 向上述实验得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液未出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.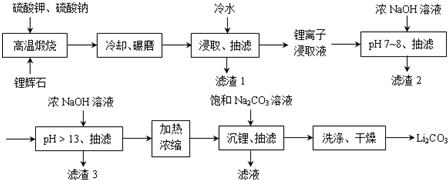
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
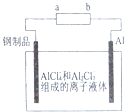 已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )| A. | a电极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH- | |
| B. | 银锌电池的电解质溶液可用稀硫酸 | |
| C. | 银锌电池放电时,负极附近溶液的pH增大 | |
| D. | Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com