
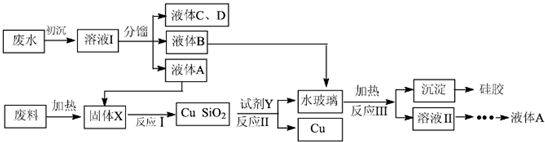
���� ���̷�����֪����ˮ�����Ҵ��������������������ᡢ�����ʹ��������������ˮ�����õ���Һ�����õ�Һ��C��D��BΪ������������AΪ�Ҵ���CDΪ�����ᡢ��������Ӧ��ΪҺ��BΪ������������ˮ������Һ��Ӧ����ˮ�⣬���ɶ����ƣ�����������Ҵ������ϼ��ȷֽ��ʽ̼��ͭ�ֽ���������ͭ��������̼��ˮ���õ�����XΪCuO��SiO2����������ͭ��Һ��AΪ�Ҵ����ȷ�Ӧ����ͭ����ȩ��ˮ���õ�Cu��SiO2���Լ�Y������Ӧ�õ���������Һ��˵���Ƕ�������ͼ���ķ�Ӧ��YΪ����������Һ��
��1������Ϊ�������أ��ܽ����Һ��������ˮ��������������������������������ʵ���Ҫ����ˮ���ã�
��2������������֪����XΪ����ͭ�Ͷ������裬�Ҵ�������ͭ���ȷ�Ӧ����ͭ����ȩ��ˮ��
��3���Լ�YΪ����������Һ���ӿ췴Ӧ���ʵĴ�ʩ�����������¡�����Ũ�ȡ�����Ӵ�����ȣ�
��4����Ӧ��Ϊ������������ˮ������Һ��ˮ�⣬�������ͼ�����õ�����Ϊ���ᣬ��Һ��Ϊ�������ƺ��Ҵ�������õ��Ҵ���
��5�����ù轺����ǿ��������Ѹ����Ч�������ܷ��װ�ڵ�ˮ�֡���ѧ�����ȶ����������ص㣬�������������壻
��� �⣺���̷�����֪����ˮ�����Ҵ��������������������ᡢ�����ʹ��������������ˮ�����õ���Һ�����õ�Һ��C��D��BΪ������������AΪ�Ҵ���CDΪ�����ᡢ��������Ӧ��ΪҺ��BΪ������������ˮ������Һ��Ӧ����ˮ�⣬���ɶ����ƣ�����������Ҵ������ϼ��ȷֽ��ʽ̼��ͭ�ֽ���������ͭ��������̼��ˮ���õ�����XΪCuO��SiO2����������ͭ��Һ��AΪ�Ҵ����ȷ�Ӧ����ͭ����ȩ��ˮ���õ�Cu��SiO2���Լ�Y������Ӧ�õ���������Һ��˵���Ƕ�������ͼ���ķ�Ӧ��YΪ����������Һ��
��1������Ϊ�������أ��ܽ����Һ��������ˮ��������������������������������ʵ���Ҫ����ˮ���ã���Ӧ�����ӷ���ʽΪ��Al3++3H2O?Al��OH��3+3H+���ʴ�Ϊ��Al3++3H2O?Al��OH��3+3H+��
��2������������֪����XΪ����ͭ�Ͷ������裬��ѧʽΪCuO��SiO2���Ҵ�������ͭ���ȷ�Ӧ����ͭ����ȩ��ˮ����Ӧ�Ļ�ѧ����ʽΪ��CH3CH2OH+CuO$\stackrel{��}{��}$Cu+H2O+CH3CHO��
�ʴ�Ϊ��CuO��SiO2��CH3CH2OH+CuO$\stackrel{��}{��}$Cu+H2O+CH3CHO��
��3������������֪�Լ�YΪ����������Һ���ӿ췴Ӧ���ʵĴ�ʩ��������������Һ���¶ȡ���������������ҺŨ�ȡ��������Ӵ�����ȣ�
�ʴ�Ϊ������������Һ��������Һ���¶ȡ���������������ҺŨ�ȡ��������Ӵ�����ȣ�
��4����Ӧ��Ϊ������������ˮ������Һ��ˮ�⣬�������ͼ�����õ�����Ϊ���ᣬ��Һ��Ϊ�������ƺ��Ҵ�������õ��Ҵ�����Ӧ�Ļ�ѧ����ʽΪ��2CH3CH2CH2COOCH2CH3+SiO32-+2H2O=2CH3CH2CH2COO-+2CH3CH2OH+H2SiO3����
�ʴ�Ϊ��2CH3CH2CH2COOCH2CH3+SiO32-+2H2O=2CH3CH2CH2COO-+2CH3CH2OH+H2SiO3����
��5���轺����ǿ��������Ѹ����Ч�������ܷ��װ�ڵ�ˮ�֡���ѧ�����ȶ����������ص㣬���������������������ȣ�
�ʴ�Ϊ���������壮
���� ���⿼�������ʷ����ᴿ������Ӧ�ã���Ҫ���������ʵķ����жϣ����̵ķ���Ӧ�ã���Ҫ�������ƶϵķ������������ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | H-H | H-F | H-Cl | H-Br |
| ����/kJ/mol | 436 | 565 | 431 | 368 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
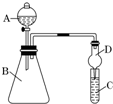 ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮
ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ΪFe3O4��SiO2 | |
| B�� | �������뻹ԭ�����ʵ�����֮��Ϊ2��3 | |
| C�� | ����1.5mol Fe2SiO4�μӷ�Ӧʱ��ת�Ƶĵ���Ϊ3 mol | |
| D�� | ����1mol CO2�μӷ�Ӧʱ����������Fe2SiO4�����ʵ���Ϊ1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | Fe��OH��3 | Fe��OH��2 |
| ��ʼ������pH | 1.5 | 6.5 |
| ������ȫ��pH | 3.7 | 9.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ʼ������pH | ������ȫ��pH | |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
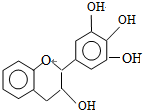
| A�� | ����ʽΪC15H12O5 | |
| B�� | 1molEGC��5molNaOHǡ����ȫ��Ӧ | |
| C�� | ����������Ӧ��ȡ����Ӧ�����ܷ�����ȥ��Ӧ | |
| D�� | ��FeCl3��Һ�ܷ�����ɫ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �縺�� ���Ӱ뾶 ���ļ��� | �۵� |
| N��O O2-��Al3+ C-H��H-O | Al��Al2O3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com