
【题目】将一块铁片放入500mL1mol/L CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,则反应后溶液中CuSO4的物质的量浓度是(反应前后溶液的体积不变)
A. 0.9mol/L B. 0.85mol/L C. 0.8mol/L D. 0.75mol/L
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
![]()
其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
Ⅰ乳酸的工业生产可以采用生物发酵法,也可以采用有机合成法,其中的一种方法是丙酸法

(1)葡萄糖的结构简式为__________,检验淀粉是否完全水解,可以选用的一种试剂是__________(填序号)。
a.溴水 b.银氨溶液 c.碘酒 d.碘化钾淀粉溶液
(2)丙酸合成法

①反应I的反应类型是___________,进行反应Ⅱ时,需要加入过量乙醇,这样做的目的是________。
②乳酸分子中有一个手性碳原子,通过两种反应可以使A中的手性碳原子失去手性。写出反应的化学方程式_____________________
Ⅱ“皂化值”是使1g 油脂皂化所需要的KOH的毫克数。某单甘油酯的皂化值数为190,通过计算可判断该油脂的名称为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液。则A、B、C分别可能为
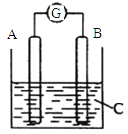
A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是AgNO3稀溶液
D.A是Ag,B是Fe,C是AgNO3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也。”天为上,所以中国古代通常称青金石为帝王石,明淸尤重。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)铝元素基态原子的外围电子轨道表示式为_____________,基态硅原子核外电子占有的原子轨道数为_____________个,氧、硫、氯的第一电离能由大到小顺序为________________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子空间构型为__________。
(3)第四周期中,与氯原子未成对电子数相同的金属元素有_______种。
(4)晶体硅的结构与金刚石非常相似。金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为____________(填化学式)。
(5)下表是一组物质的沸点数据:
有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
相对分子质量 | 32 | 42 | 34 |
沸点/℃ | 64.7 | -47.7 | -78.2 |
若只考虑相对分子质量,甲醇沸点应低于-78.2℃,甲醇沸点高的原因是________。
丙烯中含有的α键与π键个数之比为______________。
(6)铝单质为面心立方晶体,其晶胞结构如图,晶胞参数qcm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,该晶体的空间利用率为_______________(只要求列算式,不必计算出数值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1mol Na被完全氧化生成Na2O2,失去2NA个电子
B. 0.5mol锌粒与足量的盐酸反应产生H2为11.2L
C. 电解58.5g熔融的氯化钠,能产生23.0g金属钠、22.4L氯气(标准状况)
D. 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6 min的平均反应速率:v(H2O2)≈ 3.3×10﹣2 mol/(Lmin)
B. 6~10 min的平均反应速率:v(H2O2)< 3.3×10﹣2 mol/(Lmin)
C. 反应到6 min时,H2O2分解了50%
D. 反应到6 min时,c(H2O2)=0.30 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅和硅的化合物的叙述,正确的是
A. 二氧化硅溶于水可制得硅酸 B. 光导纤维的主要成分是硅
C. 二氧化硅是酸性氧化物,不跟任何酸起反应 D. 工业上可用二氧化硅和焦炭冶炼粗硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是
A. 稀硫酸 B. CuSO4溶液 C. Fe2(SO4)3溶液 D. AgNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com