
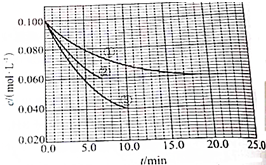
分析 (1)根据v=$\frac{△c}{△t}$计算vA,利用速率之比等于速率之比实验②中vB;
(2)在溶液中,压强对化学平衡无影响,且起始浓度不变,应为催化剂与温度对反应的影响,根据催化剂、温度对化学反应速度率和化学平衡的影响;
(3)温度升高,A的浓度降低,平衡向正反应方向移动,据此判断.
解答 解:(1)实验②中,vB=2vA=$\frac{(0.072-0.100)mol/L}{4.0min}$×2=0.014 mol/(L•min);
故答案为:0.014mol(L•min)-1;
(2)与①比较,②缩短达到平衡的时间,因催化剂能加快化学反应速度率,化学平衡不移动,所以②为使用催化剂;
与①比较,③缩短达到平衡的时间,平衡时A的浓度减小,因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,
故答案为:②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;③温度升高;达到平衡的时间缩短,平衡时A的浓度减小;
(3)因③温度升高,平衡时A的浓度减小,化学平衡向吸热的方向移动,说明正反应方向吸热,即△H>0,
故答案为:>;温度升高,平衡向正反应方向移动,故该反应为吸热反应.
点评 本题考查化学平衡浓度-时间图象、化学反应速率、化学平衡影响因素等,题目难度中等,注意掌握影响化学反应速率、化学平衡的因素,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 由 M 与其它元素形成的 1:1 型化合物一定是共价化合物 | |
| B. | XZ2 分子中含有非极性共价键 | |
| C. | 原子半径:W>Z>Y>X>M | |
| D. | 工业上常用电解法制备 W 的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+C═2CO | B. | HI+AgNO3═AgI↓+HNO3 | ||
| C. | 用高锰酸钾与浓盐酸制备氯气 | D. | 氢气在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2能和水发生化合反应生成硅酸 | |
| B. | SiO2是酸性氧化物,它不溶于任何酸 | |
| C. | SiO2的俗名叫水玻璃,不溶于水 | |
| D. | SiO2又叫水晶,能溶于NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78 g Na2O2晶体中所含阴、阳离子个数均为4NA | |
| B. | 3.4 g氨气中含有0.6NA个N-H键 | |
| C. | Na2O2的电子式为: | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氨气通入盐酸中:NH3+HCl═NH${\;}_{4}^{+}$+Cl- | |
| B. | 铁与盐酸反应:Fe+2H+=Fe3++H2↑ | |
| C. | 氯化钙溶液与碳酸钠溶液混合:Ca2++CO${\;}_{3}^{2-}$=CaCO3↓ | |
| D. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 235 | B. | 143 | C. | 92 | D. | 51 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com