
【题目】一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②CO ③CO和H2的混合物 ④HCOOCH3⑤CH3CHO
A.⑤B.①②C.①②③④D.①②③④⑤
【答案】A
【解析】
这些物质完全燃烧后生成二氧化碳或水或二者都有,2H2 +O2![]() 2H2O,2Na2O2+2H2O=4NaOH+O2↑,2CO+O2
2H2O,2Na2O2+2H2O=4NaOH+O2↑,2CO+O2![]() 2CO2,2Na2O2+2CO2 =2Na2CO3+O2;根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成不符合(CO)m(H2)n就满足题意。
2CO2,2Na2O2+2CO2 =2Na2CO3+O2;根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成不符合(CO)m(H2)n就满足题意。
这些物质完全燃烧后生成二氧化碳或水或二者都有,2H2 +O2![]() 2H2O,2Na2O2+2H2O=4NaOH+O2↑,2CO+O2
2H2O,2Na2O2+2H2O=4NaOH+O2↑,2CO+O2![]() 2CO2,2Na2O2+2CO2 =2Na2CO3+O2;根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成不符合(CO)m(H2)n就满足题意;
2CO2,2Na2O2+2CO2 =2Na2CO3+O2;根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成不符合(CO)m(H2)n就满足题意;
①②③符合(CO)m(H2)n;④HCOOCH3化学式改写为(CO)2(H2)2符合(CO)m(H2)n;⑤CH3CHO化学式改写为(CO)(H2)2C,不符合(CO)m(H2)n,故选A。
故选A。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】草酸及其盐是重要的化工原料,其中最常用的是三草酸合铁酸钾和草酸钴,已知草酸钴不溶于水,三草酸合铁酸钾晶体(![]() )易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。
)易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。

(l)草酸钴晶体(![]() )在200℃左右可完全失去结晶水。用以上装置在空气中加热5. 49 g草酸钴晶体(
)在200℃左右可完全失去结晶水。用以上装置在空气中加热5. 49 g草酸钴晶体(![]() )样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
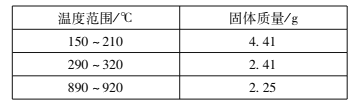
实验过程中观察到只有B中澄清石灰水明显变浑浊,E中始终没有红色固体生成。根据实验结果,290 - 320℃过程中发生反应的化学方程式是____;设置D的作用是____。
(2)用以上装置加热三草酸合铁酸钾晶体可发生分解反应。
①检查装置气密性后,先通一段时间的N2,其目的是 ___;结束实验时,先熄灭酒精灯再通入N2至常温。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则分解得到的气体产物是____。
②C的作用是是____。
(3)三草酸合铁酸钾的一种制备流程如下:
![]()
回答下列问题:
①流程“I”硫酸必须过量的原因是 ____
②流程中“Ⅲ”需控制溶液温度不高于40℃,理由是____;得到溶液后,加入乙醇,然后进行过滤。加入乙醇的理由是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol。试回答:
(1)烃A的分子式为______。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为______。
(3)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有______g烃A参加了反应,燃烧时消耗标准状况下的氧气______L。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式有(不考虑立体异构)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用下图装置对所制备的气体进行除杂、检验,其设计方案合理的是( )
制备气体 | X(除杂试剂) | Y (检验试剂) |
| |
A | CH3CH2Br与 NaOH 乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | 电石与 NaCl 水溶液 | H2O | Br2 的CCl4溶液 | |
C | C2H5OH与浓硫酸加热至 170℃ | 饱和NaHSO3溶液 | K2Cr2O7酸性溶液 | |
D | 生石灰与浓氨水 | 浓硫酸 | 酚酞溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。
I.制备氢化锂
选择图I中的装置制备氢化锂(有些装置可重复使用):
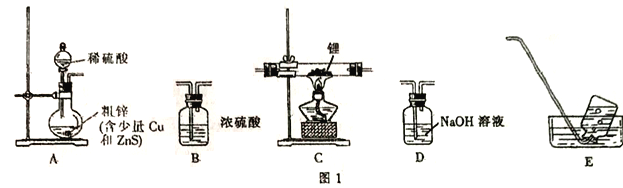
(1)装置的连接顺序(从左至右)为A→______________。
(2)检在好装蹬装置的气密性,点燃酒精灯前需进行的实验操作是_______________。
(3)写出制备氢化铝锂的化学方程式:__________________。
II. 制备氢化铝锂
1947年,Schlesinger,Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅样,充分反应后,经一系列操作得到LiAlH4晶体。
(4)写出氢化锂与无水三氯化铝反应的化学方程式:____________________。
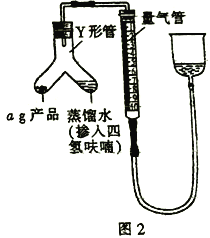
III.测定氢化铝锂产品(不含氢化锂)的纯度
(5)按图2装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是________。读数之前上下移动量气管右侧的容器,使量气管左、右有两侧的液面在同一水平面上,其目的是_________。
(6)在标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_____________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的密闭容器中充入2mol N2和7mol H2,发生反应N2+3H2=2NH3,保持其他条件不变,相同时间内测得NH3的浓度与温度的关系如图所示.下列叙述不正确的是
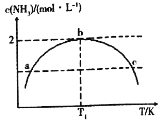
A.该反应是放热反应
B.a、c两点对应的压强 Pa<Pc
C.温度为T1时,N2的平衡转化率为50%
D.温度为T1时,再加入1mol N2和1mol NH3,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是实验室制取乙炔、洗气和性质实验所需的装置及试剂,按要求回答下列问题:

1)请选出制取乙炔气体所需的装置________(填字母,选错扣分)
2)如果将产生的气体按照发生、洗气、性质实验装置的顺序从左到右连接起来,请写出接口连接的数字顺序:发生装置出口____ 接 ____ 接____ 接_____ 或_____。(填数字)
3)写出制取乙炔的化学方程式:____________________________________________ 。
4)装置C的作用 是________________________________________________________ 。
5)如果要进行乙炔的可燃性实验,首先应该__________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应![]() 的能量变化如图所示:
的能量变化如图所示:

(1)2mol AB的总能量___________________(填“高于”或“低于”)1mol A2和1mol B2的总能量,该反应为___________(填“吸收”或“释放”)能量的反应。
(2)断裂2mol A2和2mol B2的化学键需吸收______kJ能量,断裂1.5mol AB的化学键需吸收_____kJ能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)____S+____NaOH![]() 2Na2S+____Na2SO3+____H2O
2Na2S+____Na2SO3+____H2O
(2)____Cl2+____Ca(OH)2![]() ____CaCl2+____Ca(ClO)2+____H2O
____CaCl2+____Ca(ClO)2+____H2O
(3)____P4+____KOH+____H2O=____K3PO4+____PH3↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com