
| A. | 在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,在反应中体现硫酸的还原性 | |
| B. | 向一定体积的稀硫酸中加入一定量的Cu、Fe和Fe2O3混合物,反应后有固体剩余,其可能只含铁 | |
| C. | 氢氧化镁和氢氧化铝是常见的阻燃剂,它们分解时发生吸热反应 | |
| D. | 铝在空气中表现为良好的抗腐蚀性,说明铝极难与氧气反应 |
分析 A.根据反应前后硫酸中各元素的化合价是否变化判断硫酸的作用;
B.铁的活泼性强于铜;
C.氢氧化镁和氢氧化铝均具有较高的熔点,常做阻燃剂;
D.铝极易与空气的氧气反应生成致密的氧化铝薄膜,阻止了内层铝继续被氧化;
解答 解:A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,是因为氯离子与次氯酸根离子在酸性环境下发生氧化还原反应生成氯气,反应中硫酸中的硫元素化合价不变,不体现硫酸的还原性,故A错误;
B.向一定体积的稀硫酸中加入一定量的Cu、Fe和Fe2O3混合物,稀硫酸与铁反应生成硫酸亚铁和氢气,与氧化铁反应生成硫酸铁和水,铁与三价铁离子反应生成二价铁离子,铜与三价铁离子反应生成铜离子和二价铁离子,因为铁的活泼性强于铜,若反应后有固体剩余,则剩余固体可能为铜,或者铜与铁的混合物,故B错误;
C.氢氧化镁和氢氧化铝均具有较高的熔点,常做阻燃剂,大多数物质的分解反应都是吸热的,故C正确;
D.铝属于活泼金属,极易与空气的氧气反应生成致密的氧化铝薄膜,阻止了内层铝继续被氧化,故表现出抗腐蚀性,故D错误;
故选:C.
点评 本题考查了元素化合物知识,涉及漂白粉、铁及其化合物、氢氧化铝、氢氧化镁、铝的性质,侧重考查学生对基础知识掌握熟练程度,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
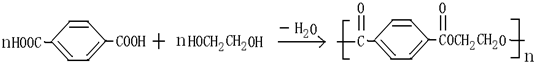
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 高锰酸钾与浓盐酸在常温下反应能产生氯气,但制取的氯气中常含有氯化氢和少量的水蒸气.某同学用如图所示的装置来制备纯净、干燥的氯气,并将用氯气与铜反应制取氯化铜.装置中除去没有考虑尾气处理外,还存在的错误是( )
高锰酸钾与浓盐酸在常温下反应能产生氯气,但制取的氯气中常含有氯化氢和少量的水蒸气.某同学用如图所示的装置来制备纯净、干燥的氯气,并将用氯气与铜反应制取氯化铜.装置中除去没有考虑尾气处理外,还存在的错误是( )| A. | ①处 | B. | ②处 | C. | ②和③处 | D. | ②③④处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL 5mol/L的盐酸 | B. | 500mL 1mol/L的氯化钠溶液 | ||
| C. | 100mL 3mol/L的硫酸 | D. | 250mL 2mol/L的氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com