
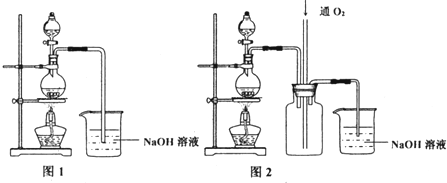
���� ��1���������⽫����Ũ����ֶ�μӵ�ͭ����ϡ����Ļ�����У���Һ©����ӦΪŨ���
��2��Ũ������ͭ��Ӧ������ԭ���ɶ�������������Ũ�ȵĽ��ͣ���NO���ɣ�ͼ2���м��װ�ÿɷ�ֹ�������������������������ķ�Ӧ��ʹ�õ�����������ȫ���գ�
��3����ӦҺ�м�FeS04��Fe2��SO4��3ʱ��Fe2��SO4��3��Cu��Ӧ����FeSO4���������ӱ���������Ϊ�����ӣ�
��4������ͭ�ھƾ����ܽ�Ƚ�С�����ݷ�ӦH2O2+Cu+H2SO4=2H2O+CuSO4�������Ҫ�õ�25.0g����ͭ���壬������Ҫ30%��H2O2 ��������������$V=\frac{m}{��}$���㣻
��� �⣺��1���ɽ�����Ũ����ֶ�μӵ�ͭ����ϡ����Ļ�����п�֪����Һ©����ӦΪŨ���ᣬ
�ʴ�Ϊ��Ũ���
��2����װ�ñȽϿ�֪��װ��2�ж����װ����ʹ��Һ�뵼�ܲ�ֱ�ӽӴ�����ֹ������ͬʱNO���������Ӧ��ʹ�к������ܱ���ȫ���գ�
�ʴ�Ϊ����ֹ�������к������ܱ���ȫ���գ�
��3����ӦҺ�м�FeS04��Fe2��SO4��3��Fe2��SO4��3��Cu��Ӧ����FeSO4���䷴Ӧ�����ӷ���ʽΪ��2Fe3++Cu=2Fe2++Cu2+��ͨ��������ܹ���������������Ϊ�����ӣ��䷴Ӧ�����ӷ���ʽΪ��4Fe2++O2+4H+=4Fe3++2H2O��
�ʴ�Ϊ��2Fe3++Cu=2Fe2++Cu2+��4Fe2++O2+4H+=4Fe3++2H2O��
��4������ͭ�ھƾ����ܽ�Ƚ�С������������95%�ľƾ���ϴCuSO4��5H2O���壬�ȿɳ�ȥ����ͭ����������ʣ��ֿɼ�������ͭ������ʧ��
��Ҫ�õ�25.0g����ͭ���壬������Ҫ30%��H2O2 ������Ϊxg��
���ݷ�ӦH2O2+Cu+H2SO4=2H2O+CuSO4��
34 160
30%x $\frac{160}{250}��25$
����x=11.33g��
�ʿ����H2O2 �����Ϊ$\frac{11.33g}{1.1g/c{m}^{3}}$=10.30mL��
�ʴ�Ϊ����ȥ����ͭ����������ʣ�����ͭ�ھƾ����ܽ�Ƚ�С���þƾ���ϴ�ɼ�������ͭ������ʧ��10.30��
���� ���⿼����ѧ����ʵ��ԭ�������⡢ʵ�鷽�������ۡ�ʵ��װ�õ����������ۡ����ӷ���ʽ����д����ѧ����ȣ��Ѷ��еȣ�������ע�����֪ʶ��������ã�


 ��ҵ����ϵ�д�
��ҵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �鷽�� | ������ | ��ɫ�� | ���巨 |
| �жϵ����� | ��Ӧ���г����������ܽ� | ��Ӧ������ɫ�仯 | ��Ӧ����������� |
| A�� | CO32---���巨 | B�� | SO42---������ | C�� | H+--��ɫ�� | D�� | Cl---���巨 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪�Ȼ�ѧ����ʽH+��aq��+OH-��aq���TH2O��l����H=-57.3kJ/mol��
��֪�Ȼ�ѧ����ʽH+��aq��+OH-��aq���TH2O��l����H=-57.3kJ/mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�Ũ�Ⱦ�Ϊ0.2mol•L-1��NaHCO3��Na2CO3��Һ�У������ڵ���ƽ���ˮ��ƽ�⣬�ֱ����NaOH����ָ���ԭ�����¶ȣ�c��CO32- �������� | |
| B�� | ��֪���ᣨHA�������Աȼ��ᣨHB�����������ʵ���Ũ�Ⱦ�Ϊ0.1 mol•L-1��NaA��NaB�����Һ�У�c��Na+����c��B-����c��A-����c�� OH-����c��HA����c��HB����c��H+�� | |
| C�� | pH��ͬ��CH3COONa��Һ��C6H5ONa��Һ��Na2CO3��Һ��NaOH��Һ����Ũ�ȣ�c��CH3COONa����c��C6H5ONa����c�� Na2CO3����c��NaOH�� | |
| D�� | һ���¶��£�pH��ͬ����Һ����ˮ���������c��H+����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
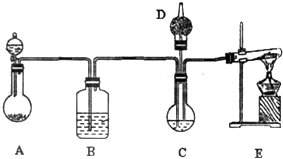 ����̼����й㷺��Ӧ��ǰ��������ͼ��ʾװ�ã���ŨCaCl2��Һ��ͨ��NH3��CO2���Ƶ�����̼��ƣ�D��װ��պϡ�������֬�ޣ�ͼ�мг�װ������ȥ��
����̼����й㷺��Ӧ��ǰ��������ͼ��ʾװ�ã���ŨCaCl2��Һ��ͨ��NH3��CO2���Ƶ�����̼��ƣ�D��װ��պϡ�������֬�ޣ�ͼ�мг�װ������ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��2-������
��2-������ ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | ��Ӧ��Ͷ����� | ��Ӧ��� ת���� | CH3OH��Ũ�� | �����仯 ��Q1��Q2��Q3������0�� |
| �� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com