
ΓΨΧβΡΩΓΩΡ≥Μ·―ß–ΓΉιΡΘΡβΓΑΚν œ÷ΤΦνΖ®Γ±Θ§“‘NaClΓΔNH3ΓΔCO2ΚΆΥ°Β»ΈΣ‘≠Νœ“‘ΦΑœ¬ΆΦΥυ ΨΉΑ÷Ο÷Τ»ΓNaHCO3Θ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣNH3+CO2+H2O+NaCl = NaHCO3Γΐ+NH4ClΓΘ»ΜΚσ‘ΌΫΪNaHCO3÷Τ≥…Na2CO3ΓΘ
Δ≈ΉΑ÷Ο““ΒΡΉς”Ο «__________ΓΘΈΣΖά÷ΙΈέ»ΨΩ’ΤχΘ§Έ≤Τχ÷–Κ§”–ΒΡ_____–η“ΣΫχ––Έϋ ’¥ΠάμΓΘ
ΔΤ”…ΉΑ÷Ο±ϊ÷–≤ζ…ζΒΡNaHCO3÷Τ»ΓNa2CO3 ±Θ§–η“ΣΫχ––ΒΡ Β―ι≤ΌΉς”–__________ΓΘNaHCO3ΉΣΜ·ΈΣNa2CO3ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___________ΓΘ
Δ«»τ‘ΎΔΤ÷–ΉΤ…’ΒΡ ±ΦδΫœΕΧΘ§NaHCO3ΫΪΖ÷Ϋβ≤ΜΆξ»ΪΘ§ΗΟ–ΓΉιΕ‘“ΜΖίΦ”»»ΝΥt1minΒΡNaHCO3―υΤΖΒΡΉι≥…Ϋχ––ΝΥ“‘œ¬ΧΫΨΩΓΘ
»ΓΦ”»»ΝΥt1minΒΡNaHCO3―υΤΖ29.6 gΆξ»Ϊ»ή”ΎΥ°÷Τ≥…»ή“ΚΘ§»ΜΚσœρ¥Υ»ή“Κ÷–ΜΚ¬ΐΒΊΒΈΦ”œΓ―ΈΥαΘ§≤Δ≤ΜΕœΫΝΑηΓΘΥφΉ≈―ΈΥαΒΡΦ”»κΘ§»ή“Κ÷–”–ΙΊάκΉ”ΒΡΈο÷ ΒΡΝΩΒΡ±δΜ·»γœ¬ΆΦΥυ ΨΓΘ
‘ρ«ζœΏcΕ‘”ΠΒΡ»ή“Κ÷–ΒΡάκΉ” «______Θ®ΧνάκΉ”ΖϊΚ≈Θ©ΘΜΗΟ―υΤΖ÷–NaHCO3ΚΆNa2CO3ΒΡΈο÷ ΒΡΝΩ÷°±» «_____ΓΘ
Δ»»τ»Γ21.0 g NaHCO3ΙΧΧεΘ§Φ”»»ΝΥt2minΚσΘ§ Θ”ύΙΧΧεΒΡ÷ ΝΩΈΣl4.8 gΓΘ»γΙϊΑ―¥Υ Θ”ύΙΧΧε»Ϊ≤ΩΦ”»κΒΫ200 mL 2 molΓΛL-1ΒΡ―ΈΥα÷–‘ρ≥δΖ÷Ζ¥”ΠΚσ»ή“Κ÷–H+ΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ_________Θ®…η»ή“ΚΧεΜΐ±δΜ·Κω¬‘≤ΜΦΤΘ©ΓΘ
ΓΨ¥πΑΗΓΩΘ®1Θ©≥ΐ»ΞΕΰ―θΜ·ΧΦ÷–ΒΡ¬»Μ·«βΤχΧεΘ®2Ζ÷Θ© Α±Τχ Θ®1Ζ÷Θ©
Θ®2Θ©Ιΐ¬ΥΓΔœ¥Β”ΓΔΉΤ…’ Θ®Ης1Ζ÷Θ© 2NaHCO3![]() Na2CO3+H2O+CO2ΓϋΘ®2Ζ÷Θ©
Na2CO3+H2O+CO2ΓϋΘ®2Ζ÷Θ©
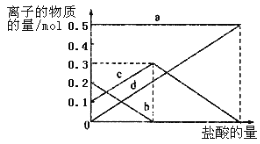
Θ®3Θ©HCO3Θ≠Θ®2Ζ÷Θ© 1:2 Θ®2Ζ÷Θ© Θ®4Θ© 0.75 mol/LΘ®2Ζ÷Θ©
ΓΨΫβΈωΓΩ ‘ΧβΖ÷ΈωΘΚΘ®1Θ©ΉΑ÷ΟΦΉ «÷Τ±ΗΕΰ―θΜ·ΧΦΤχΧεΒΡΖ¥”ΠΉΑ÷ΟΘ§…ζ≥…ΒΡΕΰ―θΜ·ΧΦΤχΧε÷–Κ§”–¬»Μ·«βΤχΧεΘ§Ε‘÷Τ±ΗΧΦΥα«βΡΤ”–”ΑœλΘ§ΉΑ÷Ο““ΒΡΉς”Ο «Έϋ ’¬»Μ·«βΤχΧεΘΜΉνΚσΒΡΈ≤Τχ÷–Κ§”–Α±Τχ≤ΜΡή≈≈Ζ≈ΒΫΩ’Τχ÷–Θ§–η“ΣΫχ––Έ≤ΤχΈϋ ’ΘΜΙ ¥πΑΗΈΣΘΚΈϋ ’HClΘΜNH3ΘΜΘ®2Θ©”…ΉΑ÷Ο±ϊ÷–≤ζ…ζΒΡNaHCO3ΖΔ…ζΒΡΖ¥”ΠΈΣΘ§NH3+CO2+H2O+NaCl=NaHCO3Γΐ+NH4ClΘΜ÷Τ»ΓNa2CO3 ±–η“ΣΙΐ¬ΥΒΟΒΫΨßΧεΘ§œ¥Β”ΚσΦ”»»ΉΤ…’ΒΟΒΫΧΦΥαΡΤΘΜΙ ¥πΑΗΈΣΘΚΙΐ¬ΥΓΔœ¥Β”ΓΔΉΤ…’ΘΜΘ®3Θ©»τ‘ΎΘ®2Θ©÷–ΉΤ…’ΒΡ ±ΦδΫœΕΧΘ§NaHCO3ΫΪΖ÷Ϋβ≤ΜΆξ»ΪΘ§ΗΟ–ΓΉιΕ‘“ΜΖίΦ”»»ΝΥt1minΒΡNaHCO3―υΤΖΒΡΉι≥…Ϋχ––ΝΥ―–ΨΩΘ°»ΓΦ”»»ΝΥt1minΒΡNaHCO3―υΤΖ29.6g Άξ»Ϊ»ή”ΎΥ°÷Τ≥…»ή“ΚΘ§»ΜΚσœρ¥Υ»ή“Κ÷–ΜΚ¬ΐΒΊΒΈΦ”œΓ―ΈΥαΘ§≤Δ≤ΜΕœΫΝΑηΘ°ΥφΉ≈―ΈΥαΒΡΦ”»κΘ§ΖΔ…ζΖ¥”Π CO32-+H+=HCO3-ΘΜ HCO3-+H+=CO2Γϋ+H2OΘΜ»ή“Κ÷–”–ΙΊάκΉ”ΒΡΈο÷ ΒΡΝΩΒΡ±δΜ·ΈΣΧΦΥαΗυάκΉ”Φθ–ΓΘ§ΧΦΥα«βΗυάκΉ”≈®Ε»‘ω¥σΘ§Β±ΧΦΥαΗυάκΉ”»Ϊ≤ΩΉΣΜ·ΈΣΧΦΥα«βΗυάκΉ”Θ§‘ΌΒΈ»κ―ΈΥαΚΆΧΦΥα«βΗυάκΉ”Ζ¥”Π…ζ≥…Εΰ―θΜ·ΧΦΘ§ΧΦΥα«βΗυάκΉ”Φθ–ΓΘ§Υυ“‘c«ζœΏ±μ ΨΒΡ «ΧΦΥα«βΗυάκΉ”≈®Ε»±δΜ·ΘΜΧΦΥαΗυάκΉ”≈®Ε»0.2mol/LΘΜΧΦΥα«βΗυάκΉ”≈®Ε»ΈΣ0.1mol/LΘΜ―υΤΖ÷–NaHCO3ΚΆNa2CO3ΒΡΈο÷ ΒΡΝΩ÷°±» «1ΘΚ2ΘΜΙ ¥πΑΗΈΣΘΚHCO3-ΘΜ 1ΘΚ2ΘΜΘ®4Θ©»τ»Γ21g NaHCO3ΙΧΧεΈο÷ ΒΡΝΩΈΣ0.25mol Θ§Φ”»»ΝΥt2minΚσΘ§ Θ”ύΙΧΧεΒΡ÷ ΝΩΈΣ14.8gΘ°“άΨίΜ·―ßΖΫ≥Χ Ϋ¥φ‘ΎΒΡ÷ ΝΩ±δΜ·ΦΤΥψΘΚ 2NaHCO3=Na2CO3+CO2Γϋ+H2OΓςm
2 1 62
0.2mol 0.1mol 21g-14.8g
Ζ¥”ΠΚσNaHCO3Έο÷ ΒΡΝΩ=0.25mol-0.2mol=0.05molΘΜNaHCO3+HCl=NaCl+H2O+CO2ΓϋΘΜœϊΚΡ¬»Μ·«βΈο÷ ΒΡΝΩ0.05molΘΜ Na2CO3Έο÷ ΒΡΝΩ=0.1molΘ§Na2CO3+2HCl=2NaCl+H2O+CO2ΓϋΘ§œϊΚΡ¬»Μ·«βΈο÷ ΒΡΝΩ0.2molΘΜ Θ”ύ¬»Μ·«βΈο÷ ΒΡΝΩ=0.200LΓΝ2mol/L-0.05mol-0.2mol=0.15molΘ§ Θ”ύ»ή“Κ÷–cΘ®H+Θ©=0.75mol/L



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
AΘ°ΡΤ «“Μ÷÷«ΩΜΙ‘≠ΦΝΘ§Ω…“‘ΫΪν―ΓΔνξΒ»Ϋπ τ¥”Τ䬻̷Έο»ή“Κ÷–÷ΟΜΜ≥ωά¥
BΘ°Ά≠Ρޔꬻ̷Χζ»ή“ΚΖ¥”ΠΘ§ΗΟΖ¥”ΠΩ…“‘”Π”Ο”Ύ”ΓΥΔΒγ¬ΖΑεΒΡ÷ΤΉς
CΘ°»ΥΟ«ΖΔœ÷ΝΥ118÷÷‘ΣΥΊΘ§Φ¥Ι≤”–118÷÷ΚΥΥΊ
DΘ°H2ΚΆD2ΜΞΈΣΆ§ΈΜΥΊ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΆ§“ΜΧθΦΰœ¬Θ§œ¬Ν–Υ≥–ρΙΊœΒ≤Μ’ΐ»ΖΒΡ «
A. ‘ΎΥ°÷–ΒΡ»ήΫβΕ»ΘΚ““Εΰ¥Φ>δε““Άι
B. »ή“ΚΒΡpHΘΚΧΦΥα«βΡΤ>±ΫΖ”ΡΤ
C. Ζ–ΒψΘΚCH3OH>HCHO
D. ”κΡΤΖ¥”ΠΒΡΩλ¬ΐΘΚΥ°>““¥Φ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΨßΧε÷–Θ§≤Μ τ”Ύ‘≠Ή”ΨßΧεΒΡ «Θ®Θ©
A. ΫπΗ’ ·B. Υ°ΨßC. ΫπΗ’…ΑD. Η…±υ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
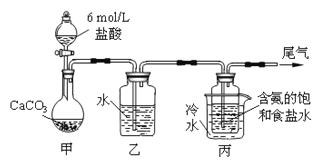
ΓΨΧβΡΩΓΩΜΤΧζΩσ ·ΒΡ÷ς“Σ≥…Ζ÷ΈΣFeS2ΚΆ…ΌΝΩFeSΘ®ΦΌ…ηΤδΥϊ‘”÷ ÷–≤ΜΚ§FeΓΔS‘ΣΥΊΘ§«“ΗΏΈ¬œ¬≤ΜΖΔ…ζΜ·―ß±δΜ·Θ©Θ§ «Έ“Ιζ¥σΕύ ΐΝρΥα≥ß÷Τ»ΓΝρΥαΒΡ÷ς“Σ‘≠ΝœΓΘΡ≥Μ·―ß–Υ»Λ–ΓΉιΕ‘ΗΟΜΤΧζΩσ ·Ϋχ––»γœ¬ Β―ιΧΫΨΩΓΘΫΪm 1 gΗΟΜΤΧζΩσ ·ΒΡ―υΤΖΖ≈»κ»γœ¬ΆΦΉΑ÷ΟΘ®Φ–≥÷ΚΆΦ”»»ΉΑ÷Ο¬‘Θ©ΒΡ ·”ΔΙή÷–Θ§¥”a¥Π≤ΜΕœΒΊΜΚΜΚΆ®»κΩ’ΤχΘ§ΗΏΈ¬ΉΤ…’ΜΤΧζΩσ―υΤΖ÷ΝΖ¥”ΠΆξ»ΪΓΘΤδΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚ
4FeS2+11O2![]() 2Fe2O3+8SO2 4FeS+7O2
2Fe2O3+8SO2 4FeS+7O2![]() 2Fe2O3+4SO2
2Fe2O3+4SO2
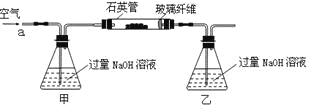
ΓΨ Β―ι“ΜΓΩΘΚ≤βΕ®Νρ‘ΣΥΊΒΡΚ§ΝΩΖ¥”ΠΫα χΚσΘ§ΫΪ““ΤΩ÷–ΒΡ»ή“ΚΫχ––»γœ¬¥ΠάμΘΚ
Θ®1Θ©ΙΡ»κΩ’ΤχΒΡΉς”Ο «__________________________________________ΓΘ
Θ®2Θ©Ζ¥”ΠΫα χΚσ““ΤΩ÷–ΒΡ»ή“Κ–ηΦ”ΉψΝΩH2O2»ή“ΚΒΡΡΩΒΡ «_______________Θ®”ΟΜ·―ßΖΫ≥Χ Ϋ±μ ΨΘ©ΓΘ
H2O2Ω…“‘Ω¥Ής «“Μ÷÷Κή»θΒΡΥαΘ§–¥≥ωΤδΒγάκΖΫ≥Χ ΫΘΚ ΓΘ
Θ®3Θ©ΗΟΜΤΧζΩσ ·÷–Νρ‘ΣΥΊΒΡ÷ ΝΩΖ÷ ΐΈΣ__________Θ®Ν–≥ω±μ¥ο ΫΦ¥Ω…Θ©ΓΘ
ΓΨ Β―ιΕΰΓΩΘΚ≤βΕ®Χζ‘ΣΥΊΒΡΚ§ΝΩ
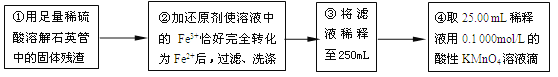
Θ®4Θ©ΔΎ÷–Θ§»τ”ΟΧζΖέΉςΜΙ‘≠ΦΝΘ§‘ρΥυ≤βΒΟΒΡΧζ‘ΣΥΊΒΡΚ§ΝΩ_______Θ®ΧνΓΑΤΪ¥σΓ±ΓΔΓΑΤΪ–ΓΓ±ΜρΓΑΈό”ΑœλΓ±Θ©ΓΘ
Θ®5Θ©Δέ÷–Θ§–η“Σ”ΟΒΫΒΡ“«Τς≥ΐ…’±≠ΓΔ≤ΘΝßΑτΓΔΫΚΆΖΒΈΙήΆβΘ§ΜΙ”–_______ΓΘ
Θ®6Θ©Ρ≥Ά§―ß“ΜΙ≤Ϋχ––ΝΥΥΡ¥ΈΒΈΕ® Β―ιΘ§ Β―ιΫαΙϊΦ«¬Φ»γœ¬ΘΚ
Β―ι¥Έ ΐ | ΒΎ“Μ¥Έ | ΒΎΕΰ¥Έ | ΒΎ»ΐ¥Έ | ΒΎΥΡ¥Έ |
œϊΚΡKMnO4»ή“ΚΧεΜΐ/mL | 25.00 | 25.03 | 20.00 | 24.97 |
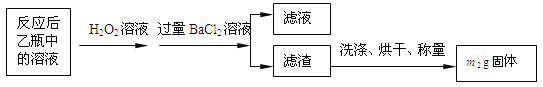
ΗυΨίΥυΗχ ΐΨίΘ§ΦΤΥψΗΟœΓ Ά“Κ÷–Fe2+ΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣc(Fe2+) ΘΫ___________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈε÷÷ΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊXΓΔYΓΔZΓΔWΓΔRΓΔXΒΡ‘≠Ή”ΑκΨΕ «ΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊ÷–Ήν¥σΒΡΘ§Y‘ΣΥΊ ΒΡ‘≠Ή”ΉνΆβ≤ψΒγΉ” ΐΈΣmΘ§¥ΈΆβ≤ψΒγΉ” ΐΈΣnΘ§Z‘ΣΥΊΒΡ‘≠Ή”L≤ψΒγΉ” ΐΈΣm+nΘ§M≤ψΒγΉ” ΐΈΣm-nΘ§W‘ΣΥΊ”κZ‘ΣΥΊΆ§÷ςΉεΘ§R‘ΣΥΊ”κY‘ΣΥΊΆ§÷ςΉεΓΘœ¬Ν––π ω¥μΈσΒΡ «
A. 60gZY2÷–Κ§”–2molZ-YΦΪ–‘Ι≤ΦέΦϋ
B. YΒΡ«βΜ·Έο±»RΒΡ«βΜ·ΈοΈ»Ε®Θ§»έΖ–ΒψΗΏ
C. ZΓΔWΓΔRΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΥ°Μ·ΈοΒΡΥα–‘«Ω»θΥ≥–ρ «ΘΚR>W>Z
D. X”κY–Έ≥…ΒΡΝΫ÷÷≥ΘΦϊΜ·ΚœΈο÷–“θΓΔ―τάκΉ”ΒΡΗω ΐ±»ΨυΈΣ1ΘΚ2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”–ΜζΈοXΒΡΖ÷Ή” ΫΈΣC5H11ClΘ§”ΟNaOHΒΡ¥Φ»ή“Κ¥ΠάμXΘ§Ω…ΒΟΒΫΖ÷Ή” ΫΈΣC5H10ΒΡΝΫ÷÷≤ζΈοYΓΔZΓΘYΓΔZΨ≠¥ΏΜ·Φ”«βΚσΕΦΩ…ΒΟΒΫ2ΦΉΜυΕΓΆιΓΘ‘ρXΒΡΫαΙΙΦρ ΫΩ…ΡήΈΣ(ΓΓΓΓ)
A. ![]() B.
B. 
C.  D.
D. 
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊΘ§aΓΔbΓΔcΓΔdΒΡ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΓΘΥΡ÷÷‘ΣΥΊ–Έ≥…ΒΡΒΞ÷ “ά¥ΈΈΣmΓΔnΓΔpΓΔqΘΜxΓΔyΓΔz «’β–©‘ΣΥΊΉι≥…ΒΡΕΰ‘ΣΜ·ΚœΈοΘ§Τδ÷–zΈΣ–Έ≥…Υα”ξΒΡ÷ς“ΣΈο÷ ÷°“ΜΘΜ25Γφ0.01molΓΛL-1w»ή“Κ÷–Θ§![]() ΓΘ…œ ωΈο÷ ΒΡΉΣΜ·ΙΊœΒ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «( )
ΓΘ…œ ωΈο÷ ΒΡΉΣΜ·ΙΊœΒ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «( )

A. ‘≠Ή”ΑκΨΕΒΡ¥σ–ΓΘΚa<b<c<d B. «βΜ·ΈοΒΡΖ–ΒψΘΚb>d
C. xΒΡΒγΉ” ΫΈΣΘΚ![]() D. yΓΔwΚ§”–ΒΡΜ·―ßΦϋάύ–ΆΆξ»ΪœύΆ§
D. yΓΔwΚ§”–ΒΡΜ·―ßΦϋάύ–ΆΆξ»ΪœύΆ§
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥ΘΈ¬œ¬Θ§”Ο0.10molΓΛL-1ΒΡNaOH»ή“ΚΖ÷±πΒΈΕ®ΧεΜΐΨυΈΣ50.00mLΓΔ≈®Ε»ΨυΈΣ0.05molΓΛL-1ΒΡHClOΓΔHFΝΫ÷÷»ή“ΚΘ§ΤδΒΈΕ®«ζœΏ»γΆΦΥυ ΨΓΘ

œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. HClOΒΡΥα–‘±»HF«Ω
B. V(NaOH»ή“Κ)=0 mL ±Θ§Ε‘”Π»ή“Κ÷–ΘΚc(ClO-)=c(F-)
C. V(NaOH»ή“Κ)=12.50 mL ±Θ§Ε‘”Π»ή“Κ÷–ΘΚc(ClO-)>c(F-)
D. V(NaOH»ή“Κ)=25.00mL ±Θ§Ε‘”Π»ή“Κ÷–ΘΚc(ClO-)<c(F-)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com