
 (写结构简式)
(写结构简式) 分析 分子式为C5H8O4的有机物,①能与饱和NaHCO3溶液反应产生气体,说明结构中含有羧基;
②既能发生银镜反应,又能发生水解反应,说明含有酯基,醛基.
其中核磁共振请谱显示为3组峰,即含有三种类型的氢原子,峰面积比为6:1:1,即三种类型氢原子的数目之比是6:1:1,据此结合同分异构体的书写方法来回答即可.
解答 解:分子式为C5H8O4的有机物,①能与饱和NaHCO3溶液反应产生气体,说明结构中含有羧基;
②既能发生银镜反应,又能发生水解反应,说明含有酯基,醛基,符合条件的结构有:HCOOC(CH3)CH2COOH,HCOOCH2C(CH3))COOH,HCOOCH(COOH)CH2CH3,HCOOCH2CH(COOH)CH3, 共5种,其中核磁共振请谱显示为3组峰,且峰面积比为6:1:1,即含有三种类型的氢原子,三种类型氢原子的数目之比是6、1、1的是
共5种,其中核磁共振请谱显示为3组峰,且峰面积比为6:1:1,即含有三种类型的氢原子,三种类型氢原子的数目之比是6、1、1的是 ,故答案为:
,故答案为: .
.
点评 本题考查学生有机物同分异构体的书写知识,注意物质的官能团的性质是解题的关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向某未知溶液中滴加几滴稀溴水 | 没有生成白色沉淀 | 溶液中一定不含苯酚 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | 分别加热Na2CO3和NaHCO3固体 试管内壁都有水珠 两种物质均受热分解 | |
| B. | 向某未知溶液中滴加几滴稀溴水 没有生成白色沉淀 溶液中一定不含苯酚 | |
| C. | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 加入淀粉后溶液变成蓝色 氧化性:Cl2>I2 | |
| D. | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 加入H2O2后溶液变成血红色 Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 热稳定性:HF>HCl>HBr>HI | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸钠溶液与稀盐酸互滴时,两种操作现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 品红溶液褪色 | B. | AgNO3溶液产生沉淀 | ||
| C. | BaCl2溶液产生沉淀 | D. | 石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:实验题
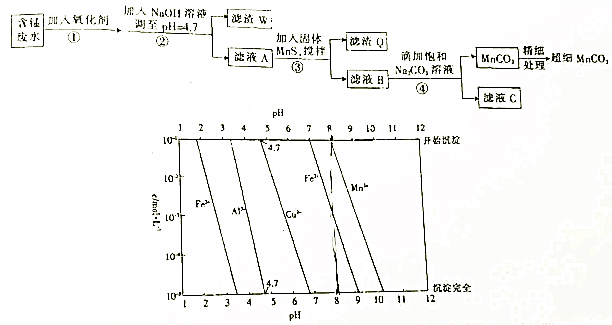
某铜矿主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O及CaCO3,部分步骤如下:

请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________(填离子符号);验证所含离子所用的试剂是在__________。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
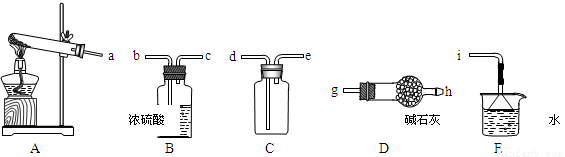
如果按气流方向连接各仪器接口,你认为正确的顺序为
a→_________、_________→_________、_________→i。
其中与i相连漏斗的作用是______________。
②为探究氨气和氯气的反应
a. 装置A、B,B装置内的药品依次是____________、____________。
b.装置C可用于探究氯气与氨气(已知氯气和氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验打开开关1、3,关闭2,先向烧瓶中通入____________,然后关闭1、3,打开2,向烧瓶中缓缓通入一定量的另一种气体。实验一段时间后向烧瓶内出现浓厚的白烟并在容器内壁凝结。

(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:
a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;
b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;
c.过滤;
d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:选择题
已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4
下列结论正确的是 ( )
A.①②③均是氧化还原反应
B.反应②中氧化剂与还原剂的物质的量之比为1∶6
C.氧化性强弱顺序是:K2Cr2O7>I2>Fe2(SO4)3
D.反应③中0.1mol还原剂共失去电子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com