
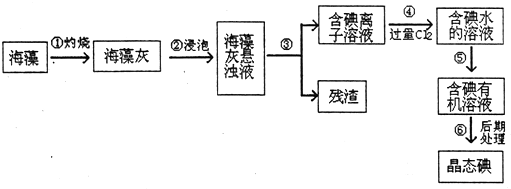
分析 海带灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用苯或四氯化碳萃取,经蒸馏可得到碘,以此解答该题.
(1)过滤操作的定义是将固体和液体分开,③是固体和液体分离用过滤方法,⑤是水溶液中碘单质被四氯化碳萃取的实验方法;
(2)氯气可以将碘离子氧化为单质碘;
(3)氯气的作用是其氧化性,可以用氢离子和过氧化氢代替将碘离子氧化为单质碘;
(4)萃取时需要的溶剂不能与水互溶;
(5)分液漏斗和普通漏斗的作用分别为萃取和过滤,碘的水溶液,用苯或四氯化碳萃取,经蒸馏可得到碘,分液萃取的实验中需要用分液漏斗和烧杯;
(6)检验溶液中是否含有碘的方法是用淀粉溶液等知识点来解题;
(7)依据碘元素守恒计算碘化钾的质量分数.
解答 解:(1)将浑浊液分成溶液和残渣的方法为过滤操作,将碘从水溶液中转移到有机相中的过程为萃取,③是固体和液体分离用过滤方法,⑤是水溶液中碘单质被四氯化碳萃取的实验方法,
故答案为:过滤;萃取;
(2)加入过量氯气是为了将溶液中的碘离子转化为单质碘,离子方程式为Cl2+2I-═I2+2Cl-,故答案为:Cl2+2I-═I2+2Cl-;
(3)加入氢离子和过氧化氢起的作用为氧化剂,将碘离子转化为单质碘,离子方程式为2H++2I-+H2O2═I2+2H2O,
故答案为:2H++2I-+H2O2═I2+2H2O;
(4)酒精和醋酸虽然也属于有机溶剂,但它们与水可以互溶,故只能选择CD四氯化碳和苯,故答案为:CD;
(5)分液漏斗用来萃取,普通漏斗用来过滤,恰好少了这两种玻璃仪器,故答案为:分液漏斗;普通漏斗;
(6)检验提取碘后的水是否有残余的单质碘,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有单质碘.
故答案为:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有单质碘;
(7)灼烧的干海藻的质量为m1 g,最后获得晶体碘质量为m2 g,碘元素物质的量=$\frac{{m}_{2}}{254}$mol,在提取过程中有16.6%的碘元素损失,原干海藻中碘元素=$\frac{\frac{{m}_{2}}{254}}{1-16.6%}$mol=$\frac{\frac{{m}_{2}}{254}}{83.4%}$mol,则该海藻中含KI的质量分数=$\frac{\frac{\frac{{m}_{2}}{254}}{83.4%}mol×166g/mol}{{m}_{1}}$×100%=≈$\frac{{m}_{2}}{1.27{m}_{1}}$×100%,
故答案为:$\frac{{m}_{2}}{1.27{m}_{1}}$×100%.
点评 本题考查了过滤操作、萃取和蒸馏中的注意事项,将碘离子转化为单质碘可以用氯气或酸性双氧水,检验单质碘的方法等知识点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
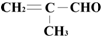 的化学性质叙述正确的是( )
的化学性质叙述正确的是( )| A. | 能发生氧化反应 | |
| B. | 与H2发生加成反应,必定得一种纯的新有机物 | |
| C. | 能发生加聚反应生成高聚物 | |
| D. | 检验-CHO可用酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
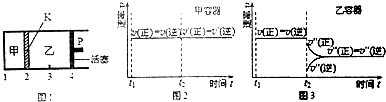
| A. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数分别为增大和减小 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率 变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
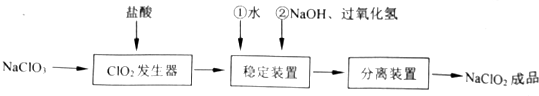
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现代元素周期表中,元素按照元素的相对原子质量递增顺序排列 | |
| B. | 最外层电子数相同的不同元素一定处于同-主族 | |
| C. | 在元素周期表中金属与非金属的分界线附近,可以找到半导体材料 | |
| D. | X2+的核外电子数目为18,则X处于笫三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com