
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列说法不正确的是( )
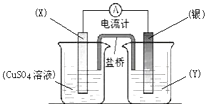
A. 电极X的材料是铜
B. 电解质溶液Y是硝酸银溶液
C. 银电极为电池的正极,发生的电极反应为:Ag++e﹣═Ag
D. 盐桥中的阳离子向硫酸铜溶液中移动
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为________________
②该反应的热化学方程式为_____________________
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:Mg(s)+H2(g)=MgH2(s)ΔH1=-74.5kJ·mol-1,Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH2,Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1,则ΔH2=____________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是

A. 放电时,H+从左槽迁移进右槽
B. 放电过程中,左槽溶液颜色由黄色变为蓝色
C. 充电时,b极接直流电源正极,a极接直流电源负极
D. 充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,A的溶解度是Sg·100g-1,其饱和溶液密度为dg·cm-3、物质的量浓度为cmol·L-1。溶液的质量分数为w,A的摩尔质量为Mg·mol-1,实验测得向一定量含A的溶液中加入mg无水A或蒸发掉ng水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )
A.S=![]()
B.c=![]()
C.S=![]()
D.c%=![]() 100%
100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25℃时,将pH=a的一元强酸溶液与pH=14﹣a的一元碱溶液等体积混合后,所得溶液呈酸性或中性
B.向醋酸钠溶液中加盐酸至溶液呈中性,则c(Clˉ)=c(CH3COOH)
C.常温下,已知CH3COOH的电离平衡常数为Ka、CH3COONa的水解平衡常数为Kh、则Ka·Kw=Kh
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液中c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫西沙星主要用于治疗呼吸道感染,物质L为合成莫西沙星的中间体,其合成路线如下:

已知:同一个碳原子上连有两个羟基不稳定,易脱水形成![]()
(1)A的化学名称为______,B中的官能团名称是______。
(2)E分子中共平面原子数目最多为________。
(3)物质G的分子式为C6H7N,其分子的核磁共振氢谱中有______个吸收峰。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。写出L的结构简式,用星号(*)标出L中的手性碳原子______________________。
(5)已知1 mol 物质J 与足量NaHCO3溶液反应生成2 mol CO2,写出D+J→K的化学方程式_________________________________________________。
(6)X是将H分子结构中的-CHO换为-NH2的同分异构体,且X苯环上有四个取代基, 则满足上述条件的X有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是有重要用途的一元弱酸。请回答下列问题:
(1)单质硼溶于热的浓硝酸可以生成硼酸,该反应的化学方程式为___________。
(2)利用铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)制硼酸,已知天然的Fe3O4不溶于酸。生产硼酸的工艺流程如下:

①“浸渣”主要成分的化学式为_____________。
②“净化除杂”:滤液保持一定温度,需先加H2O2溶液,然后再调节溶液的pH=5.6。温度不宜过高的原因是___________。调节溶液的pH=5.6的主要目的是___________。
[已知:Ksp[Fe(OH)3]=2.6×10-39], Ksp[Al(OH)3]=1.3×10-33,
[已知:Ksp[Fe(OH)2]=4.7×10-6], Ksp[Mg(OH)2]=5.6×10-12,

(3)硼酸也可以通过电解方法制备。工作原理如图所示。
①写出阳极的电极反应式___________________。
②a膜或b膜为阳离子交换膜的是________;阴极室溶液的浓度________(填“变大”、“不变”、“变小”)。
(4)写出一定条件下硼酸与氢氧化钠溶液反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是( )
A.澄清石灰水与少量小苏打溶液混合: Ca2++OH-+![]() ═CaCO3↓+H2O
═CaCO3↓+H2O
B.向FeBr2溶液中通入足量的氯气: 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
C.向NaAlO2溶液中滴加少量NaHCO3溶液: ![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]()
D.用铁电极电解饱和食盐水 2Cl-+2H2O == 2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升____________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com