
科目:高中化学 来源: 题型:
| A、离子键的本质是静电作用,阴阳离子电荷越大、离子半径越小,静电作用越强 | B、共价键的本质是共用电子对,因此必须由成键的两原子各提供一个电子形成 | C、分子晶体的基本微粒是分子,分子晶体熔沸点由分子内部共价键强弱决定 | D、原子晶体由于是空间网状结构,因此只能由碳、硅两元素构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |
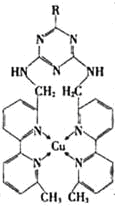 ,从而实现液化.
,从而实现液化.查看答案和解析>>
科目:高中化学 来源: 题型:
A.等离子体的基本构成微粒是带电的离子和电子及不带电的分子或原子
B.非晶体基本构成微粒的排列是长程无序和短程有序的
C.液晶内部分子沿分子长轴方向有序排列,使液晶具有各向异性
D.纳米材料包括纳米颗粒与颗粒间的界面两部分,两部分都是长程有序的
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省建瓯二中高二下学期期末考试化学试卷(带解析) 题型:填空题
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
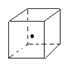
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com