
| A. | 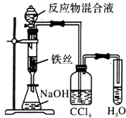 制备少量溴苯 | B. | 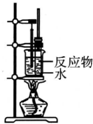 苯的硝化 | ||
| C. | 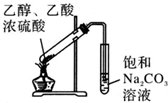 制备少量乙酸乙酯 | D. | 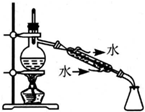 石油的分馏 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 与氢氧化钠反应的氯气一定为0.16 mol | |
| B. | n(Na+):n(Cl-)可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L或5mol/L | B. | 3mol/L或5mol/L | C. | 1mol/L或3mol/L | D. | 3mol/L或7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 g重水中所含质子数为2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 铜与足量浓硫酸共热放出4.48 LSO2时,消耗的铜原子数为0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2和Br2的沸点 | |
| B. | H-和Be2+的离子半径 | |
| C. | 同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4•5H2O的质量 | |
| D. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备的晶体硅可用于制作计算机芯片 | |
| B. | 该法制备高纯硅,可以综合利用氯气和氢气,使原料循环利用,生产成本低,效率高 | |
| C. | 该过程是把硅转化为SiHCl3与杂质分离,而后用氢气还原得到高纯硅 | |
| D. | 整个制备过程中若混有氧气可以不除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol熔融的KHSO4中含有2 NA个阳离子 | |
| B. | 1 L 0.1 mol/LCH3COONa溶液中,阴离子总数小于0.1 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA | |
| D. | 与常温常压下17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com