
| A、K+、Na+、Cl-、CO32- |
| B、Cu2+、Cl-、Na+、SO42- |
| C、Ca2+、Na+、Cl-、NO3- |
| D、Fe3+、NH4+、SCN-、HCO3-、 |


科目:高中化学 来源: 题型:
| ||
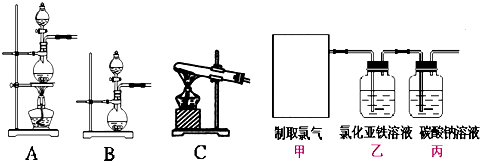
查看答案和解析>>
科目:高中化学 来源: 题型:
| 有机物 | 乙烯 | 乙炔 | 环已烷 | 苯 |
| Ω | 1 | 2 | 1 | 4 |
| A、1molΩ=3的不饱和链烃再结合6molH2即达到饱和 |
| B、C10H8的Ω=7 |
| C、C4H8的不饱和度与C3H6、C2H4的不饱和度不相同 |
| D、CH3CH2CH=CH2与环丁烷的不饱和度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH/H2O |
| △ |
 水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
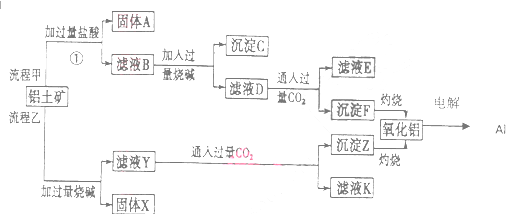
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知Ce原子序数是58,则其为镧系元素 | ||||||||
B、铈有四种稳定的核
| ||||||||
| C、用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
| D、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 称量次序 | 加热温度(℃) | 容器+试样质量(g) |
| Ⅰ | 常温 | 62.2 |
| Ⅱ | T1 | 56.8 |
| Ⅲ | T2 | 49.6 |
| Ⅳ | T3 | 44.2 |
| Ⅴ | T4 | 44.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-和Cl-一定不存在 |
| B、A13+和NH4+一定存在 |
| C、Mg2+一定存在,Al3+存在可能 |
| D、SO42-的浓度是0.1mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com