
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
分析 (1)图表中电离平衡常数K比较得到酸性强弱:HSCN>CH3COOH>H2CO3>HCN>HCO3-,铵越弱对应盐水解程度越大,溶液PH越大;
(2)CH3COOH溶液加水稀释过程,促进电离,由于溶液的体积增大,所以c(H+)减小,Kw不变,则c(OH-)增大,据此分析;
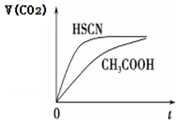
(3)由生成二氧化碳的曲线斜率可知HSCN反应较快,则可知HSCN中中c(H+)较大,说明HSCN酸性较强,再利用盐类水解的规律来分析离子浓度的关系;
(4)根据溶液中的电荷守恒和物料守恒来计算;25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-),$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{c({H}^{+})}$;
(5)碳酸钠溶液中碳酸根离子水解溶液显碱性.
解答 解:(1)电离平衡常数K比较得到酸性强弱:HSCN>CH3COOH>H2CO3>HCN>HCO3-,铵越弱对应盐水解程度越大,溶液PH越大,等物质的量浓度的 a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为cbda,
故答案为:cbda;
(2)A.CH3COOH溶液加水稀释过程,促进电离,由于溶液的体积增大的程度大,所以c(H+)减小,故A不选;
B.$\frac{c({H}^{+})}{C(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,CH3COOH溶液加水稀释过程,促进电离,氢离子物质的量增大,醋酸物质的量减小,则稀释过程中比值变大,故B选;
C.稀释过程,c(H+)减小,c(OH-)增大,c(H+)•c(OH-)=Kw,Kw只受温度影响所以不变,故C不选;
故答案为:B;
(3)由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)<c(SCN-),
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
(4)CH3COOH与CH3COONa的混合溶液中,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,
$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{c({H}^{+})}$=$\frac{1.7×1{0}^{-5}}{1{0}^{-6}}$=17,
故答案为:9.9×10-7; 17;
(5)碳酸钠溶液中碳酸根离子结合水电离出的氢离子促进水电离平衡正向进行,溶液显碱性,离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-.
点评 本题考查弱电解质的电离、盐类水解的关系,为高频考点,题目以图象题的形式较好的训练学生利用信息来分析问题、解决问题的能力,注意把握题目的分析,题目度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )| A. | 0.1mol•L-1H2C2O4溶液使KMnO4溶液褪色的离子方程式:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 0.1 mol•L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铁片与电源正极相连、碳棒与电源负极相连放入食盐水中,证明铁被保护 | |
| B. | 电解AlCl3溶液制取铝单质 | |
| C. | 用25 mL滴定管量出14.80 mL溶液 | |
| D. | 用pH试纸测得某碱溶液的pH为12.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 由X元素形成的单质可能导电 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol | |
| B. | 2 CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=+1780kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ/mol | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=-1780kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逸出SO3气体 | B. | 逸出SO2气体 | ||
| C. | 析出BaO3沉淀 | D. | 析出BaSO4沉淀和BaSO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 可用25mL酸式滴定管量取20.00mL KMnO4溶液 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 用pH计测得某溶液的pH为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾中铁显+6价 | |
| B. | Fe3+的氧化性强于FeO42- | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为3:2 | |
| D. | 用K2FeO4处理废水时其转化为Fe3+,因此K2FeO4具有杀菌和吸附双重作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com