
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
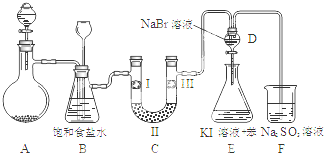
分析 漂粉精固体和浓盐酸发生Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,B中饱和食盐水可除去HCl,装置C的实验目的是验证氯气是否具有漂白性,可将氯气通入湿润的有色布条、干燥后再通入干燥的有色布条进行对比,装置D、E的目的是比较氯、溴、碘的非金属性,氯气和D中KBr反应生成溴,溴、氯气都可氧化KI,F为尾气处理装置,用于吸收氯气,以此解答该题.
解答 解:(1)漂粉精固体含有Ca(ClO)2,和浓盐酸发生反应生成氯气,方程式为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
(2)氯气难溶于饱和食盐水,而氯化氢易溶于水,B中饱和食盐水可除去HCl,如C中发生堵塞,则锥形瓶中液面下降,长颈漏斗中液面上升,
故答案为:除去Cl2中的HCl;锥形瓶中液面下降,长颈漏斗中液面上升;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中a中碱石灰可与氯气反应,b的氯气未经干燥可使干燥的有色布条褪色,c中不能用浓硫酸作为干燥剂,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,
故答案为:d;
(4)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡;观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色;氯气具有强氧化性,过量的氯气能够将碘离子氧化成碘单质,所以该现象不能说明溴的非金属性强于碘,
故答案为:E中溶液分为两层,上层(苯层)为紫红色;不能;过量的Cl2也可将I-氧化为I2.
点评 本题以氯气的制备为载体考查了氯气的性质,侧重于学生的分析能力和实验能力的考查,为高频考点,题目难度中等,解题时注意把握氯气的性质、制法、装置的作用及氧化还原反应原理为解答的关键.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98g | |
| B. | 1mol O2的体积是22.4L | |
| C. | 18g H2O含有的原子总数为3NA | |
| D. | 0.1 mol•L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | 砹化氢很稳定 | D. | 砹化银不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 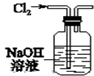 用图装置除去Cl2中混有的少量HCl | |
| B. | 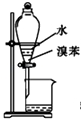 用图装置分离水和溴苯的混合物 | |
| C. | 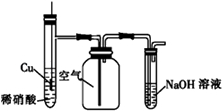 用图装置制备并收集NO气体 | |
| D. |  用图装置蒸干AlCl3饱和溶液制备AlCl3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 标况下气体的摩尔体积约为22.4升 | |
| C. | 1L0.5mol/LFeCl3的溶液与0.2L1mol/LKCl溶液中Cl-数目之比为15:2 | |
| D. | 100mL1mol/LNaCl溶液与50mL1mol/LAlCl3溶液中Cl-物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 | |
| B. | 变价金属一定是过渡元素 | |
| C. | 不含金属元素的化合物也可能是离子化合物 | |
| D. | 显酸性的溶液中溶质只能是酸或强酸弱碱盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com