
A.2NaCl(熔融) 2Na + Cl2↑ 2Na + Cl2↑ |
| B.Al2O3 +3C ="====" 2Al + 3CO↑ |
C.Fe2O3 + 3CO  2Fe + 3CO2↑ 2Fe + 3CO2↑ |
D.2Ag2O 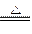 4Ag + O2↑ 4Ag + O2↑ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
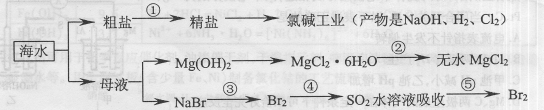
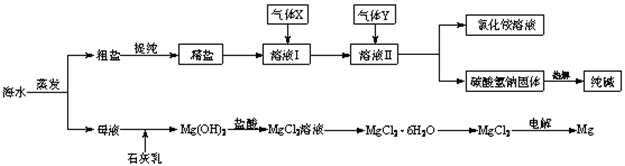
| A.在工段③和⑤中需要用到氯碱工业的产物 |
| B.工段②中的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.大量的含Fe3+废水排人海洋,易引发赤潮 |
| D.工段①中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液一过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
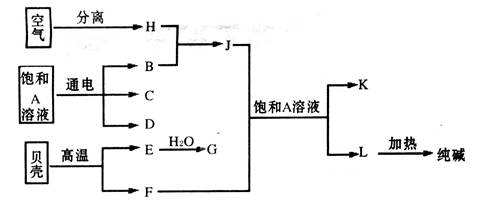

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1 H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2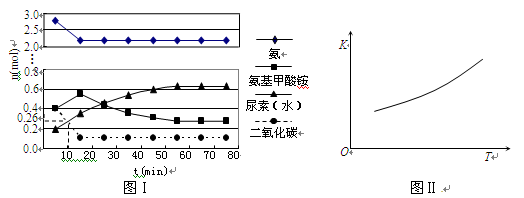
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.汽油 | B.酒精 | C.苯 | D.水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.光导纤维是以二氧化硅为主要原料制成的 |
| B.大气中二氧化碳的含量增加是酸雨的形成主要原因 |
| C.在西部和沿海地区兴建风力发电站,解决能源短缺问题 |
D.推广利用微生物发酵技术, 将植物桔杆、动物粪便等制成沼气以替代液化石油气符合“低碳经济” 将植物桔杆、动物粪便等制成沼气以替代液化石油气符合“低碳经济” |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
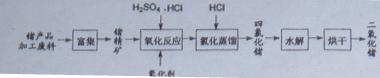
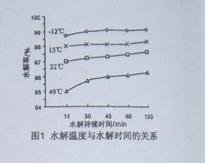
 2O2反应生成Ge4+,写出该反应的离子方程式 。
2O2反应生成Ge4+,写出该反应的离子方程式 。 (2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。 。
。

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开发核能、太阳能、氢能等新能源,使用无磷洗涤剂都可直接降低碳排放 |
| B.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| C.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| D.针对节能减排需要大力建设火电厂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com