
| A. | Cl2和澄清石灰水反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 实验室用大理石和稀醋酸制取CO2:CaCO3+2H+═Ca2++CO2↑+H2O |
分析 A.Cl2通入澄清石灰水中,氯气和氢氧化钙反应,生成氯化钙、次氯酸钙、水;
B.NaHCO3溶液与NaOH溶液反应生成碳酸钠和水;
C.氯化铝加入过量氨水生成氢氧化铝沉淀和氯化铵,氢氧化铝难溶于弱碱氨水;
D.碳酸钙与乙酸反应生成乙酸钙和二氧化碳和水,乙酸为弱酸写化学式.
解答 解:A.离子方程式中,澄清石灰水属于溶液拆写成离子,Cl2和澄清石灰水反应:Cl2+2OH-═Cl-+ClO-+H2O,故A正确;
B.NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O,故B错误;
C.氯化铝加入过量氨水生成氢氧化铝沉淀和氯化铵,氢氧化铝难溶于弱碱氨水,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.大理石与醋酸反应生成醋酸钙、水和二氧化碳气体,醋酸为弱酸,需要保留分子式,正确的离子方程式为:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
,故D错误;
故选A.
点评 本题考查了离子方程式书写原则和注意问题,注意判断难溶物、弱电解质等是解该题关键,题目难度不大,注意明确判断离子方程式的方法(1)检查反应能否发生;(2)检查反应物、生成物是否正确;(3)检查各物质拆分是否正确;(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等);(5)检查是否符合原化学方程式,然后灵活运用即可;该题有助于培养学生分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
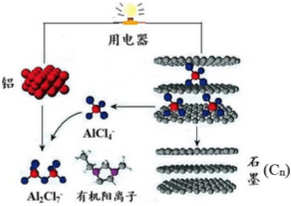 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 放电时,有机阳离子向铝电极方向移动 | |
| C. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- | |
| D. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
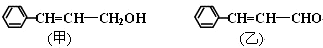
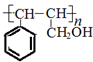 .
.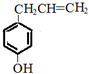 .
.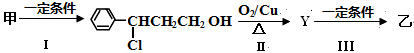
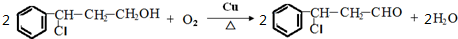 .
.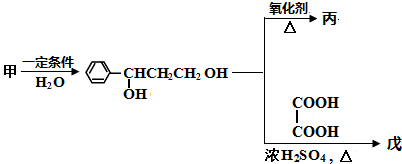
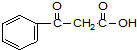 .
.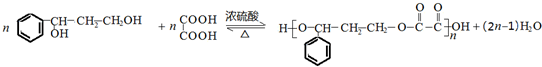 ;若戊为环状化合物,其结构简式是
;若戊为环状化合物,其结构简式是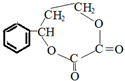 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铝是应用最广泛的两种金属.完成下列填空:
铁、铝是应用最广泛的两种金属.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
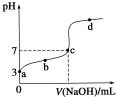 常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下向20mL 0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3mol/L | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | 滴定过程中溶液中的n (CH3COO-)+n(CH3COOH)的和不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上海世博会很多场馆的外墙使用的非晶体薄膜,以充分利用天阳能,体现低碳经济 | |
| B. | 金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法 | |
| C. | 若在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 常温时,某可逆反应的平衡常数越大则其反应速率就越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的低价氧化物、Z的单质水溶液均具有漂白性,且与O3漂白的原理相同 | |
| B. | X与Z形成的化合物和W2Y的晶体类型相同 | |
| C. | 工业上常用电解相应的盐溶液制备W、X、Z的单质 | |
| D. | X元素的盐溶液可能呈酸性,也可能呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
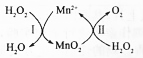 MnSO4可用作催化剂和生产微量元素肥料等,回答下列问题:
MnSO4可用作催化剂和生产微量元素肥料等,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
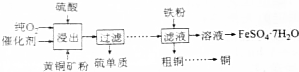
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com