
 2D(g) ��H=��QKJ��mol��1��������������ݼ��±���
2D(g) ��H=��QKJ��mol��1��������������ݼ��±���| ʵ���� | ʵ��� | ʵ��� | ʵ��� |
| ��Ӧ�¶�/�� | 800 | 800 | 850 |
| ��ƽ��ʱ��/min | 40 | 10 | 30 |
| c(D)ƽ��/mol��L��1 | 0.5 | 0.5 | 0.15 |
| ��Ӧ�������仯/KJ | Q1 | Q2 | Q3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧƽ�ⳣ����ָһ�������µĿ��淴Ӧ��������Ũ�ȵ���֮���뷴Ӧ��Ũ�ȵ���֮���ı�ֵ�� |
| B����֪4HCl(g)��O2(g)=2H2O(g)��2Cl2(g) ���Է����У���÷�Ӧ��H��0����S>0 |
| C�������������䣬����ѹǿ��ƽ������ƶ�����ƽ�ⳣ��һ������ |
| D������Ʒ������п�������Ʒ������������������������ҷ���ԭ������ͬ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(��)�ﵽƽ��ı�־��
2C(��)�ﵽƽ��ı�־���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
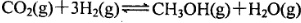 ��5 min��Ӧ�ﵽƽ��ʱc(CH3OH)Ϊ0.2 mol
��5 min��Ӧ�ﵽƽ��ʱc(CH3OH)Ϊ0.2 mol ��CO2(g)��ƽ�����ʵ���Ũ��c(CO2)���¶ȹ�ϵ��ͼ��ʾ������˵���������
��CO2(g)��ƽ�����ʵ���Ũ��c(CO2)���¶ȹ�ϵ��ͼ��ʾ������˵���������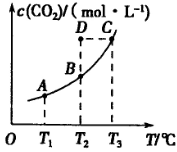
A�� 0��5 min��CO2��ƽ����Ӧ����Ϊ0��04 mol��(L��min) |
B����Ӧ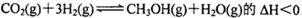 |
C����T2��ʱ������Ӧ����״̬D����һ���� |
| D����T1�桢T2��ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1>K2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Fe(s) + H2O��K��0.52����ʹ��������1.0 mol FeO����ԭ����Ӧǰ������Ӧ����a mol H2����a��ӽ�
Fe(s) + H2O��K��0.52����ʹ��������1.0 mol FeO����ԭ����Ӧǰ������Ӧ����a mol H2����a��ӽ�| A��1.0 | B��2.0 | C��3.0 | D��4.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
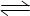 I3��(aq)���ڷ�Ӧ��ƽ����ϵ�У�c(I3��)���¶�T�Ĺ�ϵ��ͼ��ʾ�������ϵ��κ�һ�㶼��ʾƽ��״̬����
I3��(aq)���ڷ�Ӧ��ƽ����ϵ�У�c(I3��)���¶�T�Ĺ�ϵ��ͼ��ʾ�������ϵ��κ�һ�㶼��ʾƽ��״̬����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)����X��Y��Z��ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ0����λmol/L��������ƽ��ʱX��Y��Z��Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.08mol/L���������жϲ���������
2Z(g)����X��Y��Z��ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ0����λmol/L��������ƽ��ʱX��Y��Z��Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.08mol/L���������жϲ��������� | A��c1:c2 = 1:3 | B��ƽ��ʱ��Y��Z����������֮��Ϊ3:2 |
| C��X��Y��ת���ʲ���� | D��c1��ȡֵ��ΧΪ0 < c1 < 0.14mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)+CO2(g)����֪15��ʱ��ƽ��������Ũ��Ϊ2.4��10-3mol/L������˵������ȷ����
2NH3(g)+CO2(g)����֪15��ʱ��ƽ��������Ũ��Ϊ2.4��10-3mol/L������˵������ȷ����| A���ܱ������������ƽ����Է�������������÷�Ӧ�ﵽƽ��״̬ |
| B��15��ʱ��������淋ķֽ�ƽ�ⳣ��Ϊ2.048��10-9��mol/L��3 |
| C��������ѹ�������NH3�����������С |
| D���ټ���һ������������泥��ɼӿ췴Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��g������H=��92.4 kJ��mol��1����������ȷ����
2NH3��g������H=��92.4 kJ��mol��1����������ȷ����| A���ﵽ��ѧƽ��ʱ���������¶ȣ�������Ӧ���ʼ�С���淴Ӧ�������� |
| B������λʱ��������x mol N2��ͬʱ����2x mol NH3����Ӧ�ﵽƽ��״̬ |
| C���ﵽƽ������������СΪԭ����һ�룬���´ﵽƽ���c��NH3����Ϊԭƽ��ʱ��2�� |
| D�����ﵽƽ��ʱ�����ų�46.2kJ����������l mo1NH3��g������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com