
分析 由实验①知晶体含钾元素,由实验④知晶体中含有SO42-,由实验②③⑤⑥知B是Al(OH)3,晶体A中含有Al3+,故综合①~⑥知A是KAl(SO4)2•xH2O,由⑦所给数据可求出x,由此可确定A及其他物质的化学式.
解答 解:①取少量A晶体做焰色反应实验,透过蓝色钴玻璃观察,火焰呈紫色,证明A中含钾元素;
②取少量A晶体溶于水可以得到无色的溶液,该溶液使石蕊试液变红,说明溶液呈酸性;
③取少量A的溶液加过量氨水,有白色沉淀B生成,说明生成金属的氢氧化物沉淀不溶于氨水;
④过滤除去③中的B后,在滤液中滴加氯化钡溶液,有白色沉淀C生成,C不溶于稀硝酸,证明A中含有SO42-离子,沉淀C为BaSO4;
⑤取少量B滴加氢氧化钠溶液,得无色溶液D,⑥取少量B滴加盐酸,得无色溶液E,证明B是两性氢氧化物,判断B为Al(OH)3,则D为NaAlO2,E为AlCl3;
⑦将47.4g A晶体在120℃下加热脱水,剩余物的质量为25.8g.可知失去结晶水的质量47.4g-25.8g=21.6g,综合①~⑥知A是KAl(SO4)2•xH2O,KAl(SO4)2的质量为25.8g,物质的量=$\frac{25.8g}{258g/mol}$=0.1mol,结晶水物质的量=$\frac{21.6g}{18g/mol}$=1.2mol,故x=12,推断得到A的化学式为:KAl(SO4)2•12H2O
故答案为:KAl(SO4)2•12H2O;Al(OH)3;BaSO4;NaAlO2 ; AlCl3.
点评 本题考查无机物推断,侧重考查根据实验现象判断离子存在、氢氧化铝的两性、定量计算确定物质化学式,题目难度中等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
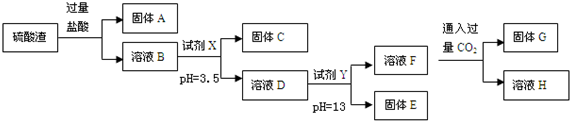
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
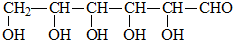 B.CH3CH2OH
B.CH3CH2OH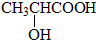 乳酸 D.
乳酸 D.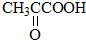 丙酮酸
丙酮酸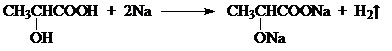 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):
一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可以增大正反应速率,减小逆反应速率 | |
| B. | 使用催化剂可以使化学平衡正向移动 | |
| C. | 使用催化剂可以降低反应的活化能 | |
| D. | 使用催化剂可以改变反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
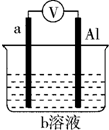 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑧ | B. | ③⑩ | C. | ①⑥ | D. | ②⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com