

分析 足量氯气通入氢氧化钾溶液中低温反应生成次氯酸钾、氯化钾和水,加入固体氢氧化钾除去氯化钾得到减小次氯酸钾浓溶液,加入硝酸铁浓溶液纯化洗涤干燥得到高铁酸钾;
(1)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;根据化合价升高,还原剂,得到氧化产物结合电子守恒计算转移5mol电子消耗氯气物质的量;
(2)根据生产工艺流程图,第①步氯气过量,第③步需要碱性条件,在温度较高时KOH 与Cl2 反应生成的是KClO3,氧化还原反应中化合价有升有降;
(3)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;
(4)检验最后一次的洗涤中无Cl-即可
(5)根据氧化还原反应电子得失守恒配平;
解答 解:(1)据题目信息、氧化还原反应中化合价发生变化确定产物有:KClO3、KCl、H2O,根据电子得失守恒和质量守恒来配平,可得6KOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O;Cl2既是氧化剂又是还原剂,氯化合价升高,得到 KClO3,KClO3是还原产物.
氯元素化合价0价变化为-1价,+1价,电子转移为e-,氯元素化合价0价变化为+5价,电子转移5mol,转移5mol电子时消耗氯气3mol,
故答案为:6KOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O; 3;
(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,故A正确;
B、因温度较高时KOH 与Cl2 反应生成的是KClO3,而不是KClO,故B错误;
C、第③步需要碱性条件,所以碱要过量,故C正确;
D、KClO3转化为 KClO,化合价只降不升,故D错误;
故选:A、C.
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
(4)因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净.
故答案为:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净.
(5)根据电子得失守恒和质量守恒来配平,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
故答案为:4,10,4,3,8OH-;
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、离子的检验等,培养了学生运用知识的能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(SO2)/mol•L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
| c(CO)/mol•L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
| A. | 当v(SO2)正=2v(CO)逆时,该反应达到了平衡状态 | |
| B. | X的化学式为CO2 | |
| C. | 前1s内v(X)=1.00mol•L-1•s-1 | |
| D. | 上述反应达到平衡时,CO的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
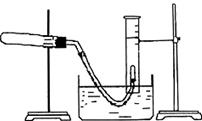 利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:
利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
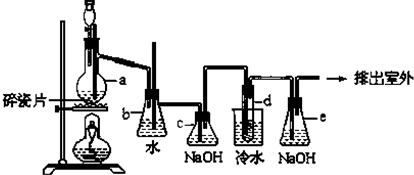
 工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.
工业上常利用含硫废水生产Na2S2O3•5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程.实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品.| 步骤 | 实验操作 | 实验现象 |
| I | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
| II | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入 足量稀盐酸 | 沉淀未完全溶解,并有刺激性气味的气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | Na2SiO3 | C. | Na2CO3 | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| B. | 铜丝在氯气中燃烧:Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$Cu2++2Cl- | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O | |
| D. | 氯化铁溶液腐蚀铜箔制印刷线路板:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com