
 ;甲烷燃烧的化学方程式为:CH4+2O2
;甲烷燃烧的化学方程式为:CH4+2O2
| ||
| 光照 |
 ;CH4+2O2
;CH4+2O2
| ||
| 光照 |


科目:高中化学 来源: 题型:
 控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池(盐桥起到导电作用).下列判断不正确的是( )
控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池(盐桥起到导电作用).下列判断不正确的是( )| A、反应开始时,乙中石墨电极上发生氧化反应 |
| B、反应开始时,甲中石墨电极作负极 |
| C、电流计读数为零时,反应达到化学平衡状态 |
| D、电流计读数为零后,在甲中溶入FeCl2,电流表可能会再次产生偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出
(1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
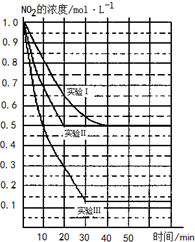 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com