
A、 称量25.0g氯化钠固体 |
B、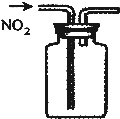 收集NO2气体(尾气处理装置略) |
C、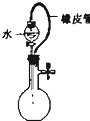 检验出此装置漏气 |
D、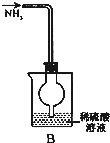 吸收NH3不会造成倒吸 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、 用如图装置制取少量金属锰 |
D、 实验室用如图所示装置制取少量氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石和盐酸的反应:CO32-+2H+=CO2↑+H2O | ||||
| B、向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ | ||||
| C、氯气与氢氧化钠溶液反应:Cl2+OH-=Cl-+HClO | ||||
D、电解饱和食盐水:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若v1=v2c1=c2,则混合液中c(NH4+)=c(C1-) |
| B、若混合液的pH=7,则混合液中c(NH4+)>c(C1-) |
| C、若v1=v2且pH<7,则一定有c1<c2 |
| D、若混合液的pH=7,则c1v1>c2v2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
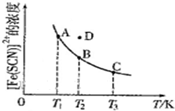 FeCl3溶液与KSCN溶液混合,发生反应:Fe3+(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)△H.其中[Fe(SCN)]2+的浓度与温度T的关系如图所示.下列说法正确的是( )
FeCl3溶液与KSCN溶液混合,发生反应:Fe3+(aq)+SCN-(aq)?[Fe(SCN)]2+(aq)△H.其中[Fe(SCN)]2+的浓度与温度T的关系如图所示.下列说法正确的是( )| A、△H>O |
| B、反应处于D点时,一定有v正<v逆 |
| C、溶液中c(Fe3+):A点>B点 |
| D、T1、T2时相应的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B、氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C、向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D、粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
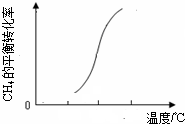 则△H2
则△H2查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32- |
| B、将SO2通入酸性高锰钾溶液中,溶液褪色,不能说明SO2具有漂白性 |
| C、高温时碳能置换出二氧化硅中的硅,说明还原性碳比硅强 |
| D、亚硫酸是良好的还原剂,浓H2SO4是良好的氧化剂,但两者混合,却不发生氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com