
| A. | 用加入过量氨水并过滤的方法除去NaCl溶液中混有的AlCl3 | |
| B. | 除去NaCl溶液中少量的Na2S:加入AgCl后再过滤 | |
| C. | 向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3 | |
| D. | 除去FeCl3溶液中少量的CuCl2:加入足量铁粉,过滤 |
分析 A.氯化铝与氨水反应生成沉淀和氯化铵;
B.Na2S与AgCl发生沉淀的转化;
C.碳酸钙促进氯化铁的水解,生成氯化钙;
D.二者均与Fe反应.
解答 解:A.氯化铝与氨水反应生成沉淀和氯化铵,引入新杂质,故A错误;
B.Na2S与AgCl发生沉淀的转化,过滤可除杂,故B正确;
C.碳酸钙促进氯化铁的水解,生成氯化钙,应加MgO等促进水解,然后过滤,故C错误;
D.二者均与Fe反应,不能除杂,应选氧化铁促进铜离子水解,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离方法、沉淀的转化、盐类水解、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
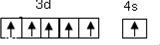 .
.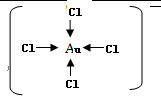 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
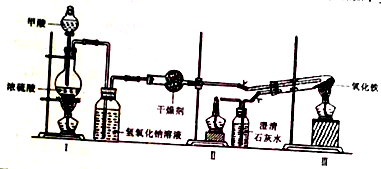
| 加热方式 | 产物元素组成 | 各元素的质量分数/% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在医疗上碳酸钠、Al(OH)3均可用于治疗胃酸过多 | |
| B. | 人造刚玉的熔点很高,可用作高级耐火材料,其主要成分是SiO2 | |
| C. | 水玻璃可用于生产粘合剂和防火剂 | |
| D. | 自来水中加入少量明矾,水解生成Al(OH)3胶体可以起到杀菌消毒的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com